1 . 实验小组制备高铁酸钾( )并探究其性质。
)并探究其性质。
资料: 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
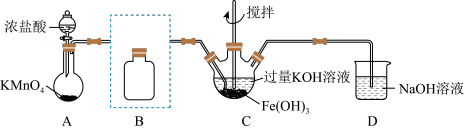
①A为氯气发生装置。A中反应离子方程式是_______
②除杂装置B的作用是:_______ 所用试剂为_______
③C中得到紫色固体和溶液。C中 发生的反应有:
发生的反应有: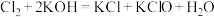 ,
, 。
。
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案Ⅰ中溶液变红可知a中含有 离子,但
离子,但 不一定是
不一定是 将
将 还原产生的,还可能由
还原产生的,还可能由_______ 产生(用离子方程式表示)。
ⅱ.方案Ⅱ可证明 氧化了
氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是_______ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
 )并探究其性质。
)并探究其性质。资料:
 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)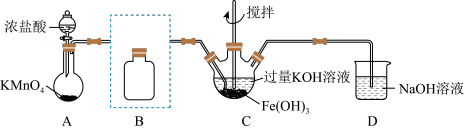
①A为氯气发生装置。A中反应离子方程式是
②除杂装置B的作用是:
③C中得到紫色固体和溶液。C中
 发生的反应有:
发生的反应有: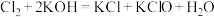 ,
, 。
。(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色|溶液b,取少量b,滴加盐酸,有 溶出,得到紫色|溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 离子,但
离子,但 不一定是
不一定是 将
将 还原产生的,还可能由
还原产生的,还可能由ⅱ.方案Ⅱ可证明
 氧化了
氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水的处理剂,制备流程如图所示:

某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2,在碱性溶液中较稳定。
(1)反应Ⅲ中能够得到高铁酸钾的原因是___ 。
(2)若实验室用高锰酸钾与浓盐酸制取少量氯气,则反应的最佳装置应选用图中的___ (填标号),反应的离子方程式为___ 。
a.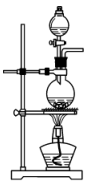 b.
b.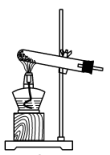
c.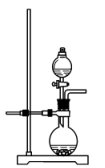 d.
d.
(3)制备K2FeO4的实验装置如图。装置中仪器乙的名称为____ ,实验时应先打开活塞K2的原因是____ ,为了提高氯气的利用率,可采取的措施是__ 。
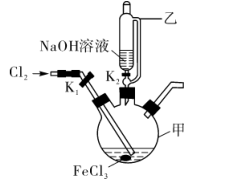
(4)验证酸性条件下氧化性 >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,___ (实验中须使用的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)。
(5)根据K2FeO4的制备实验得出:氧化性Cl2> ,和第(4)小题实验表明的Cl2和
,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___ 。

某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2,在碱性溶液中较稳定。
(1)反应Ⅲ中能够得到高铁酸钾的原因是
(2)若实验室用高锰酸钾与浓盐酸制取少量氯气,则反应的最佳装置应选用图中的
a.
 b.
b.
c.
 d.
d.
(3)制备K2FeO4的实验装置如图。装置中仪器乙的名称为

(4)验证酸性条件下氧化性
 >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,(5)根据K2FeO4的制备实验得出:氧化性Cl2>
 ,和第(4)小题实验表明的Cl2和
,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2021-10-25更新
|
487次组卷
|
2卷引用:新疆喀什地区疏附县2022届高三下学期第一次模拟化学试题
名校
解题方法
3 . 下列实验设计能达到实验目的的是
| 实验目的 | 实验设计 | |
| A | 酸性条件下,氧化性:H2O2>Fe3+ | 向 溶液中滴加用硫酸化的 溶液中滴加用硫酸化的 溶液,溶液变黄色 溶液,溶液变黄色 |
| B | 干燥的氯气没有漂白性 | 将一片鲜花花瓣放入盛有干燥氯气的集气瓶中 |
| C | 酸性:CH3COOH>HClO | 用pH试纸分别测定同浓度的CH3COOH溶液和HClO溶液的pH |
| D | 还原性:Fe2+>Br- | 将少量的氯水滴入FeBr2溶液中,再滴加CCl4振荡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-02更新
|
149次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
4 . 下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将新制氯水滴到淀粉KI试纸上 | 试纸变蓝色 | 氧化性:I2>Cl2 |
| B | 将过量的CO2通入CaCl2溶液中 | 产生白色沉淀 | 酸性:HCl>H2CO3 |
| C | FeSO4溶液中滴入酸性高锰酸钾溶液 | 紫色褪色 | Fe2+有还原性 |
| D | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-10-25更新
|
256次组卷
|
4卷引用:新疆和田地区于田县2022-2023学年高三上学期11月期中化学试题
名校
5 . 室温下,下列实验探究方案不能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向盛有 溶液的试管中滴加几滴 溶液的试管中滴加几滴 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 | 证明 具有还原性 具有还原性 |
| B | 用玻璃棒蘸取某无色溶液后在酒精灯火焰上灼烧,观察火焰颜色 | 检验溶液中有 |
| C | 向盛有淀粉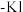 溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 | 比较 和 和 的氧化性强弱 的氧化性强弱 |
| D | 向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,观察脱脂棉燃烧 | 证明过氧化钠与水反应放热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-03更新
|
193次组卷
|
3卷引用:新疆生产建设兵团第三师图木舒克市第二中学2023-2024学年高一下学期开学考试化学试题
6 . 根据所学知识回答下列问题:
(1)氢化钠(NaH)可在野外作生氢剂,NaH中氢元素显 价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。
价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。
①该反应中体现了H2O的_______ (填“氧化性”、“还原性”或“氧化性和还原性”)。
②用双线桥法表示该反应中电子转移的方向和数目:___________________ 。
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,反应原理为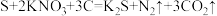 。
。
①该反应中,每生成0.5molN2,消耗S的质量为_______ g。
②氧化剂是_______ (填化学式)。
③若将生成的固体物质溶于水配成溶液,然后通入氯气,发生反应的离子方程式为___________ 。
(3)含重铬酸根离子( )的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为
)的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为 。
。
① 作用为
作用为_______ 。
②氧化性:Fe3+_______ (填“>”、“<”或“=”)  。
。
③该反应中,每生成0.6molFe3+,消耗FeSO4∙7H2O的物质的量为_______ 。
(1)氢化钠(NaH)可在野外作生氢剂,NaH中氢元素显
 价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。
价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。①该反应中体现了H2O的
②用双线桥法表示该反应中电子转移的方向和数目:
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,反应原理为
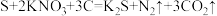 。
。①该反应中,每生成0.5molN2,消耗S的质量为
②氧化剂是
③若将生成的固体物质溶于水配成溶液,然后通入氯气,发生反应的离子方程式为
(3)含重铬酸根离子(
 )的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为
)的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为 。
。①
 作用为
作用为②氧化性:Fe3+
 。
。③该反应中,每生成0.6molFe3+,消耗FeSO4∙7H2O的物质的量为
您最近一年使用:0次
7 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)“维生素C可以将食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有_____ (填“氧化性”或“还原性”)。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:
_____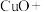 _____
_____
 _____
_____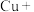 _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应_____ 。
②该反应中,氧化剂是_____ (填化学式),被氧化的元素是_____ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为
的反应为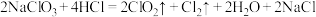
①该反应中的还原产物是_____ (写化学式),反应中每生成1个 分子,转移电子的数目为
分子,转移电子的数目为_____ 。
②用双线桥标出反应中电子转移的方向和数目_____ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是_____ (填序号)
A. B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为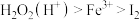 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为_____ 。
(1)“维生素C可以将食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:_____
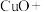 _____
_____
 _____
_____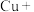 _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为
的反应为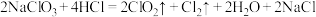
①该反应中的还原产物是
 分子,转移电子的数目为
分子,转移电子的数目为②用双线桥标出反应中电子转移的方向和数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为
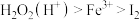 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近一年使用:0次
2023-07-05更新
|
445次组卷
|
2卷引用:新疆石河子第一中学2023-2024学年高一上学期9月月考化学试题
解题方法
8 . 勤劳致富,越努力越幸福。下列劳动项目与所述的化学知识没有关联的是
选项 | 劳动项目 | 化学知识 |
A | 游泳池中加硫酸铜进行消毒 | 硫酸铜的氧化性 |
B | 高铁酸钾常用于处理水 | 高铁酸钾的氧化性和氢氧化铁胶体的吸附性 |
C | 用热的纯碱溶液洗去油污 | 热的纯碱溶液水解显碱性 |
D | 用厨余垃圾制肥料 | 厨余垃圾含N、P等元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br﹣②2Br﹣+Cl2=Br2+2Cl﹣③2Fe3++2I﹣=2Fe2++I2,由此判断下列说法正确的是
| A.铁元素在反应①中被还原,在③中被氧化 |
| B.反应②中当有1 个Cl2分子被氧化时,有2 个Br-被还原 |
| C.氧化性强弱顺序为Cl2>I2>Br2>Fe3+ |
| D.还原性强弱顺序为I->Fe2+>Br->Cl- |
您最近一年使用:0次
2022-10-19更新
|
293次组卷
|
3卷引用:新疆昌吉市教育共同体2022-2023学年高一上学期第一次月考化学试题
10 . 将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O= +2Fe2++4H+;
+2Fe2++4H+; +6Fe2++14H+=2Cr3++6Fe3++7H2O,则下列说法正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O,则下列说法正确的是
 +2Fe2++4H+;
+2Fe2++4H+; +6Fe2++14H+=2Cr3++6Fe3++7H2O,则下列说法正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O,则下列说法正确的是| A.还原性Cr3+>Fe2+>SO2 | B.氧化性 >SO2>Fe3+ >SO2>Fe3+ |
C. 能将Na2SO3氧化成Na2SO4 能将Na2SO3氧化成Na2SO4 | D.两个反应中Fe3+均作氧化剂 |
您最近一年使用:0次



