2020届高考化学二轮复习大题精准训练 ——有机物制备综合实验
全国
高三
专题练习
2020-02-07
265次
整体难度:
适中
考查范围:
有机化学基础、化学实验基础
2020届高考化学二轮复习大题精准训练 ——有机物制备综合实验
全国
高三
专题练习
2020-02-07
265次
整体难度:
适中
考查范围:
有机化学基础、化学实验基础
一、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
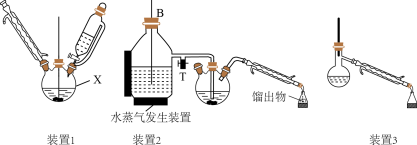
1. 苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4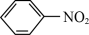 +9Fe+4H2O
+9Fe+4H2O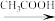 4
4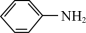 +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__ 。
(2)仪器X的名称是__ ;加入硝基苯时,“逐滴加入”的目的是__ 。
(3)分离提纯过程中加入NaCl固体的作用是__ 。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__ ;装置2中长导管B的作用是__ 。
(5)萃取分液操作过程中要远离明火和热源,原因是__ 。
(6)温度T的范围为__ ,实验结束得到6.0mL产物,则苯胺的产率为__ (保留三位有效数字)。
4
 +9Fe+4H2O
+9Fe+4H2O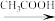 4
4 +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
| 名称 | 密度(g•mL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
| 硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
| 苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
| 乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为
(2)仪器X的名称是
(3)分离提纯过程中加入NaCl固体的作用是
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是
(5)萃取分液操作过程中要远离明火和热源,原因是
(6)温度T的范围为
您最近一年使用:0次
2020-02-03更新
|
571次组卷
|
2卷引用:2020届高考化学二轮复习大题精准训练 ——有机物制备综合实验
解答题-实验探究题
|
较难(0.4)
2. 实验室用无水乙酸钠和碱石灰混合制甲烷:CH3COONa+NaOH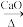 CH4↑+Na2CO3,
CH4↑+Na2CO3,
为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:__ 。
(2)C装置中的试剂为__ ,作用是__ 。
(3)实验测得消耗的CH4和CuO的质量比为1:20,则D中硬质玻璃管内发生反应的化学方程式为__ 。
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:①试管中有少量白雾;②导管内液面上升;③__ ;④___ 。
(5)有关该实验的说法,正确的是__ (填字母)。
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B装置中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
D.G装置的大试管取下黑色纸套后,光照强度越大,CH4与Cl2越易发生取代反应
(6)实验室还可用碳化铝(Al4C3)固体与H2O反应制备甲烷,写出反应的化学方程式:__ 。
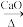 CH4↑+Na2CO3,
CH4↑+Na2CO3,为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:
(2)C装置中的试剂为
(3)实验测得消耗的CH4和CuO的质量比为1:20,则D中硬质玻璃管内发生反应的化学方程式为
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:①试管中有少量白雾;②导管内液面上升;③
(5)有关该实验的说法,正确的是
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B装置中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
D.G装置的大试管取下黑色纸套后,光照强度越大,CH4与Cl2越易发生取代反应
(6)实验室还可用碳化铝(Al4C3)固体与H2O反应制备甲烷,写出反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
解题方法
3. 常温下对甲基苯甲醚为无色液体,具有紫罗兰的香气,可由对甲基苯酚与甲醇在浓硫酸催化作用下制取,反应装置(部分夹持装置已略去)如图所示:

制备反应为 。可能用到的数据如下:
。可能用到的数据如下:
().合成反应:在图1的烧瓶中先加入几片碎瓷片,再依次加入10.8g对甲基苯酚、10mL甲醇,最后加入2mL浓硫酸,控制反应温度为60 (水浴加热)进行反应。
(水浴加热)进行反应。
(2).产物提纯:①将反应混合液冷却后加入足量饱和碳酸钠溶液,充分反应后转移至分液漏斗中,静置分液;②将有机层转移至图2烧瓶中,加热,控制温度为100 进行蒸馏,待蒸馏结束后,向烧瓶内剩余液体中加入足量无水氯化钙,然后趁热过滤,并将所得液体再次进行蒸馏,收集177
进行蒸馏,待蒸馏结束后,向烧瓶内剩余液体中加入足量无水氯化钙,然后趁热过滤,并将所得液体再次进行蒸馏,收集177 左右馏分,蒸馏结束后,称量所得馏分为7.32g。
左右馏分,蒸馏结束后,称量所得馏分为7.32g。
回答下列问题:
(1)仪器A的名称为____ 。
(2)向图1的烧瓶中加入碎瓷片的目的是____ ;采用水浴加热的目的是_____ 。
(3)产物提纯时,向反应混合液中加入足量饱和碳酸钠溶液的作用是_____ ;产物提纯时,先控制温度为100℃进行蒸馏的目的是____ 。
(4)加入足量无水氯化钙的目的是_____ 。
(5)收集到的177℃左右的馏分主要是_____ (填名称)。
(6)对甲基苯甲醚的产率为_____ 。

制备反应为
 。可能用到的数据如下:
。可能用到的数据如下:物质 物理性质 | 甲醇 | 对甲基苯酚 | 对甲基苯甲醚 |
| 熔点/℃ | -97 | 34.7 | -32.1 |
| 沸点/℃ | 64.7 | 202 | 177 |
| 密度/(g‧cm-3) | 0.79 | 1.03 | 0.969 |
| 水溶性 | 易溶 | 难溶 | 不溶 |
 (水浴加热)进行反应。
(水浴加热)进行反应。(2).产物提纯:①将反应混合液冷却后加入足量饱和碳酸钠溶液,充分反应后转移至分液漏斗中,静置分液;②将有机层转移至图2烧瓶中,加热,控制温度为100
 进行蒸馏,待蒸馏结束后,向烧瓶内剩余液体中加入足量无水氯化钙,然后趁热过滤,并将所得液体再次进行蒸馏,收集177
进行蒸馏,待蒸馏结束后,向烧瓶内剩余液体中加入足量无水氯化钙,然后趁热过滤,并将所得液体再次进行蒸馏,收集177 左右馏分,蒸馏结束后,称量所得馏分为7.32g。
左右馏分,蒸馏结束后,称量所得馏分为7.32g。回答下列问题:
(1)仪器A的名称为
(2)向图1的烧瓶中加入碎瓷片的目的是
(3)产物提纯时,向反应混合液中加入足量饱和碳酸钠溶液的作用是
(4)加入足量无水氯化钙的目的是
(5)收集到的177℃左右的馏分主要是
(6)对甲基苯甲醚的产率为
您最近一年使用:0次
2020-08-14更新
|
219次组卷
|
6卷引用:2020届高考化学二轮复习大题精准训练 ——有机物制备综合实验
解答题-实验探究题
|
适中(0.65)
真题
名校
4. 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是__________________ 。
(2)加入碎瓷片的作用是_______________ ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时_____________ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________ 。
(4)分液漏斗在使用前须清洗干净并____________ ;在本实验分离过程中,产物应该从分液漏斗的_________________ (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________ 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有___________ (填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是____________ (填正确答案标号)。
A.41% B.50% C.61% D.70%

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是
(2)加入碎瓷片的作用是
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
(4)分液漏斗在使用前须清洗干净并
(5)分离提纯过程中加入无水氯化钙的目的是
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是
A.41% B.50% C.61% D.70%
您最近一年使用:0次
2019-01-30更新
|
4258次组卷
|
15卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅰ卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅰ卷)2016届湖南省湘潭凤凰中学高三第一次月考化学试卷2015-2016学年黑龙江大庆实验中学高二下期末化学试卷2016-2017学年黑龙江省牡丹江市第一高级中学高二上学期开学检测化学试卷2016-2017学年江西省南昌市八一中学、洪都中学、麻丘中学、十七中、桑海中学高二3月联考化学试卷山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题甘肃省酒泉市敦煌中学2019届高三一诊化学试题青海省西宁市沛西中学2019届高三年第一次月考化学试题高二人教版选修5 综合测评 模块测评卷(一)山东省淄博市淄川中学2018-2019学年高二下学期期中考试化学试题2020届高考化学二轮复习大题精准训练 ——有机物制备综合实验湖北省黄石市第二中学2019--2020学年高二下学期5月考试化学试题山西省太原市山西大学附属中学2019-2020学年高二下学期5月化学试题(已下线)第30讲 认识有机化合物-2021年高考化学一轮复习名师精讲练湖北省石首市第一中学2019-2020学年高二下学期摸底考试化学试题
解答题-实验探究题
|
适中(0.65)
5. 乙酰水杨酸,俗称阿司匹林( ),是常用的解热镇痛药。实验室合成流程如下:
),是常用的解热镇痛药。实验室合成流程如下:

查阅资料:
阿司匹林:受热易分解,溶于乙醇、难溶于水
水杨酸(邻羟基苯甲酸):溶于乙醇、微溶于水
醋酸酐[(CH3CO)2O]:无色透明液体,溶于水形成乙酸
请根据以上信息回答下列问题:
(1)①合成阿司匹林时,下列几种加热方式最合适的_____________ 。

②合成阿司匹林使用的锥形瓶必须干燥的原因是______________ 。
③如右图所示装置,通过抽滤可使粗产品与母液分离。下列说法不正确的是____________ 。

A.抽滤能加快过滤速率,得到相对干燥的沉淀,但颗粒太小的沉淀不能用此装置
B.当溶液具有强酸性、强氧化性时,可用玻璃砂漏斗代替布氏漏斗
C.抽滤时,当吸滤瓶内液面快到支管口时,先拔掉吸滤瓶上橡皮管,再从吸滤瓶支管口倒出溶液
D.洗涤晶体时,先关闭水龙头,用洗涤剂缓慢淋洗,再打开水龙头抽滤
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤。加入饱和NaHCO3溶液的目的是(用化学反应方程式表示)__________________ 。
(3)另一种改进的提纯方法,称为重结晶提纯法。

①最后步骤中洗涤剂最好选择_______________ 。
A.15%的乙醇溶液 B.NaOH溶液 C.冷水 D.滤液
②下列装置在上述流程中肯定用不到的是_______________ 。

③重结晶时为了获得较大颗粒的晶体产品,查阅资料得到如下信息:

1.不稳定区出现大量微小晶核,产生较多颗粒的小晶体
2.亚稳过饱和区,加入晶种,晶体生长
3.稳定区晶体不可能生长
由信息和已有的知识分析,从温度较高浓溶液中获得较大晶体颗粒的操作为______________ 。
 ),是常用的解热镇痛药。实验室合成流程如下:
),是常用的解热镇痛药。实验室合成流程如下:
查阅资料:
阿司匹林:受热易分解,溶于乙醇、难溶于水
水杨酸(邻羟基苯甲酸):溶于乙醇、微溶于水
醋酸酐[(CH3CO)2O]:无色透明液体,溶于水形成乙酸
请根据以上信息回答下列问题:
(1)①合成阿司匹林时,下列几种加热方式最合适的

②合成阿司匹林使用的锥形瓶必须干燥的原因是
③如右图所示装置,通过抽滤可使粗产品与母液分离。下列说法不正确的是

A.抽滤能加快过滤速率,得到相对干燥的沉淀,但颗粒太小的沉淀不能用此装置
B.当溶液具有强酸性、强氧化性时,可用玻璃砂漏斗代替布氏漏斗
C.抽滤时,当吸滤瓶内液面快到支管口时,先拔掉吸滤瓶上橡皮管,再从吸滤瓶支管口倒出溶液
D.洗涤晶体时,先关闭水龙头,用洗涤剂缓慢淋洗,再打开水龙头抽滤
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤。加入饱和NaHCO3溶液的目的是(用化学反应方程式表示)
(3)另一种改进的提纯方法,称为重结晶提纯法。

①最后步骤中洗涤剂最好选择
A.15%的乙醇溶液 B.NaOH溶液 C.冷水 D.滤液
②下列装置在上述流程中肯定用不到的是

③重结晶时为了获得较大颗粒的晶体产品,查阅资料得到如下信息:

1.不稳定区出现大量微小晶核,产生较多颗粒的小晶体
2.亚稳过饱和区,加入晶种,晶体生长
3.稳定区晶体不可能生长
由信息和已有的知识分析,从温度较高浓溶液中获得较大晶体颗粒的操作为
您最近一年使用:0次
2016-12-09更新
|
887次组卷
|
5卷引用:2016届浙江省温州市高三3月模拟(选考)化学试卷
2016届浙江省温州市高三3月模拟(选考)化学试卷2020届高考化学二轮复习大题精准训练 ——有机物制备综合实验(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
解答题-实验探究题
|
较难(0.4)
名校
6. 甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(2)三颈瓶中发生反应的化学方程式为
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
您最近一年使用:0次
2018-11-14更新
|
209次组卷
|
4卷引用:广西壮族自治区贵港市覃塘高级中学2018-2019学年高二上学期9月月考化学试题



