三轮冲刺2020届高三化学考题必刷——物质含量定量探究分析题
全国
高三
专题练习
2020-02-12
22次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、常见无机物及其应用、认识化学科学、有机化学基础
三轮冲刺2020届高三化学考题必刷——物质含量定量探究分析题
全国
高三
专题练习
2020-02-12
22次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、常见无机物及其应用、认识化学科学、有机化学基础
一、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
1. 氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:________ 。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是________ 。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8 + 2NaOH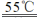
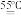 Na2S2O8 + 2NH3↑ + 2H2O
Na2S2O8 + 2NH3↑ + 2H2O
副反应:3Na2S2O8 + 2NH3 + 6NaOH 6Na2SO4 + N2 + 6H2O
6Na2SO4 + N2 + 6H2O
某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。
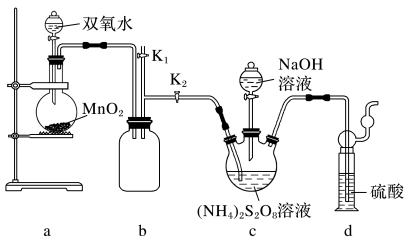
(3)装置b的作用是________ 。
(4)装置a中反应产生的气体需要持续通入装置c的原因是________ 。
(5)上述装置中还需补充的实验仪器或装置有________  填字母
填字母 。
。
A.温度计
B.洗气瓶
C.水浴装置
D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg∙L-1。
②Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先与CN-反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的现象是________ 。
(7)处理后的废水中氰化钠的浓度为_______ mg∙L-1;处理后的废水是否达到排放标准?_______ (填“是”或“否”)。
Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8 + 2NaOH
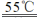
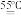 Na2S2O8 + 2NH3↑ + 2H2O
Na2S2O8 + 2NH3↑ + 2H2O副反应:3Na2S2O8 + 2NH3 + 6NaOH
 6Na2SO4 + N2 + 6H2O
6Na2SO4 + N2 + 6H2O某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是
(4)装置a中反应产生的气体需要持续通入装置c的原因是
(5)上述装置中还需补充的实验仪器或装置有
 填字母
填字母 。
。A.温度计
B.洗气瓶
C.水浴装置
D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg∙L-1。
②Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先与CN-反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的现象是
(7)处理后的废水中氰化钠的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
解题方法
2. 氮化钙(Ca3N2)时一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙并测定其纯度,设计如下实验
Ⅰ.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为______ 。
(2)钙和氮气制备氮化钙的装置如下(夹持装置略去):

上述装置合理的连接顺序为______ (按气流方向,用接口字母表示,装置不重复使用)。
(3)按连接好的装置进行实验。
①实验步骤如下:检查装置气密性、加入药品:______ (请按正确顺序填入下列步骤的字母标号)。
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为______ 。
③装置C的硬质玻璃管中的现象为______
(4)设计实验证明Ca3N2中混有钙单质:______
Ⅱ.测定氮化钙纯度
ⅰ称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00mol/L的盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00mL稀释后的溶液,用0.2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00mL。
(5)所取固体中氮化钙的质量分数为______ 。
Ⅰ.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为
(2)钙和氮气制备氮化钙的装置如下(夹持装置略去):

上述装置合理的连接顺序为
(3)按连接好的装置进行实验。
①实验步骤如下:检查装置气密性、加入药品:
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为
③装置C的硬质玻璃管中的现象为
(4)设计实验证明Ca3N2中混有钙单质:
Ⅱ.测定氮化钙纯度
ⅰ称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00mol/L的盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00mL稀释后的溶液,用0.2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00mL。
(5)所取固体中氮化钙的质量分数为
您最近一年使用:0次
2019-12-02更新
|
552次组卷
|
9卷引用:河北省衡水中学2017届高三大联考(全国卷)理科综合化学试题
解答题-实验探究题
|
适中(0.65)
解题方法
3. 工业含铬废水的处理原理是将 转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
(1)工业上处理100L 含量为108mg∙L-1的含铬废水,至少需要
含量为108mg∙L-1的含铬废水,至少需要______ L(标准状况) SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6mol∙L-1),需调节溶液pH______ 。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考查反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是______ 。
(4)光照下,草酸(H2C2O4)也能将 转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后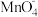 被还原成Mn2+),消耗浓度为0.4000mol∙L-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。
被还原成Mn2+),消耗浓度为0.4000mol∙L-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。_________

 转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。(1)工业上处理100L
 含量为108mg∙L-1的含铬废水,至少需要
含量为108mg∙L-1的含铬废水,至少需要(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6mol∙L-1),需调节溶液pH
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考查反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是
(4)光照下,草酸(H2C2O4)也能将
 转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后
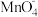 被还原成Mn2+),消耗浓度为0.4000mol∙L-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。
被还原成Mn2+),消耗浓度为0.4000mol∙L-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。
您最近一年使用:0次
4. (1)将下列性质的编号,填入各小题后面对应的横线中:
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。______
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。______
③在冷浓HNO3中放入铝片没明显现象.______
④用稀硫酸清洗金属表面的氧化物。______
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是______ 。
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)

①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):______ 接 ______ , ______ 接 ______ , ______ 接 ______ ;
②有怎样的实验现象才表明已检验出CO2?______ 。
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。
③在冷浓HNO3中放入铝片没明显现象.
④用稀硫酸清洗金属表面的氧化物。
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)

①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
②有怎样的实验现象才表明已检验出CO2?
您最近一年使用:0次
2020-02-09更新
|
78次组卷
|
2卷引用:三轮冲刺2020届高三化学考题必刷——物质含量定量探究分析题
解答题-实验探究题
|
困难(0.15)
5. 为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究。已知:碱式碳酸钴受热时可分解生成三种氧化物。

(1)按如图所示装置组装好仪器,并___________ ;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中_______ (填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是__________ 。
(2)某同学认为上述实验中存在一个缺陷,该缺陷是_________ 。
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为__________ 。
(4)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取COCl2·6H2O的一种工艺如下:

已知:25℃时
①净化除杂时,加入H2O2发生反应的离子方程式为______________ ;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为_________ ;
③加盐酸调整pH为2~3的目的为___________ ;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。

(1)按如图所示装置组装好仪器,并
(2)某同学认为上述实验中存在一个缺陷,该缺陷是
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为
(4)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取COCl2·6H2O的一种工艺如下:

已知:25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为
③加盐酸调整pH为2~3的目的为
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。
【知识点】 物质含量的测定
您最近一年使用:0次
2016-12-09更新
|
261次组卷
|
2卷引用:2015届山东省泰安市高三下学期二轮复习质量检测理综化学试卷



