实验室用KMnO4和浓HCl来快速制取少量Cl2;产物除了Cl2,还有KCl、MnCl2和H2O。方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)请用双线桥表明上述方程式中电子转移的方向和数目_____ ;
(2)该反应中的浓HCl体现了_____ ;
A.氧化性 B.还原性 C.既有氧化性又有还原性 D.酸性
(3)该反应中的氧化剂是______ ,氧化产物是_______ 。
(4)若要制备标准状况下3.36L的Cl2,则参加反应的KMnO4固体质量为________ g。
(1)请用双线桥表明上述方程式中电子转移的方向和数目
(2)该反应中的浓HCl体现了
A.氧化性 B.还原性 C.既有氧化性又有还原性 D.酸性
(3)该反应中的氧化剂是
(4)若要制备标准状况下3.36L的Cl2,则参加反应的KMnO4固体质量为
更新时间:2020-08-26 08:38:07
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________ (填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________ (填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO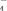 +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________ 。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______ (标准状况),被氧化的HCl的物质的量为____ 。
(5)除去镁粉中混入的铝粉杂质用溶解、_______ 方法,化学反应方程式为___________________ 。
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是
(2)H2O2既体现氧化性又体现还原性的反应是
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO
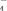 +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O写出该氧化还原反应的离子方程式:
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为
(5)除去镁粉中混入的铝粉杂质用溶解、
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氧化还原反应在亚硝酸盐的制取和转化中有重要的应用。
(1) (亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
(亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
①该反应中的氧化剂是____________ 。
②该反应中被氧化的N原子与被还原的N原子的物质的量之比为____________ 。
③每生成3 molCa(NO2)2,反应转移电子的物质的量为____________ mol。
(2)某氧化还原反应中的所有物质为NaNO2、Na2SO4、NO、H2SO4、NaI、I2和H2O。已知NaNO2是反应物。
①写出该反应的化学方程式并用单线桥标出电子转移的方向和数目:____________ 。
②由该反应可以得到物质的氧化性顺序是_________ >________ 。
(1)
 (亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
(亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
①该反应中的氧化剂是
②该反应中被氧化的N原子与被还原的N原子的物质的量之比为
③每生成3 molCa(NO2)2,反应转移电子的物质的量为
(2)某氧化还原反应中的所有物质为NaNO2、Na2SO4、NO、H2SO4、NaI、I2和H2O。已知NaNO2是反应物。
①写出该反应的化学方程式并用单线桥标出电子转移的方向和数目:
②由该反应可以得到物质的氧化性顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2+2H2O
(1)该反应中发生还原反应的物质是___________ 。氧化产物是___________ 。
(2)用双线桥标出方程式中的电子得失。2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2+2H2O,___________
(3)当有0.2mol电子发生转移时,生成的氯气的体积为___________ L(标准状况)。被氧化的HCl的物质的量为___________ mol。
(4)若分别用①KMnO4(还原产物是Mn2+);②MnO2(还原产物是Mn2+);③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是___________ (填编号)。
(5)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:将这6种物质分别填入下面对应的横线上,组成一个配平 的化学方程式:___________+___________+H2SO4→___________+___________+___________(填化学式),___________
(1)该反应中发生还原反应的物质是
(2)用双线桥标出方程式中的电子得失。2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2+2H2O,
(3)当有0.2mol电子发生转移时,生成的氯气的体积为
(4)若分别用①KMnO4(还原产物是Mn2+);②MnO2(还原产物是Mn2+);③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是
(5)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:将这6种物质分别填入下面对应的横线上,组成一个
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】为消除燃煤烟气中含有的 、
、 ,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将 气体转化为
气体转化为 的总反应化学方程式是
的总反应化学方程式是___________ 。
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。 还原NO的化学方程式是
还原NO的化学方程式是___________ 。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的 、NO转化为
、NO转化为 、
、 。
。
①在碱性条件下,NaClO溶液吸收烟气中 的离子方程式是
的离子方程式是___________ 。
②一定时间内,温度对硫、硝脱除率的影响曲线如图, 的脱除率高于NO,可能的原因是
的脱除率高于NO,可能的原因是___________ 。(1种即可)。 和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的
和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、
、 ,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
,研究者提出了若干烟气“脱硫”、“脱硝”的方法。(1)向燃煤中加入适量石灰石,高温时将
 气体转化为
气体转化为 的总反应化学方程式是
的总反应化学方程式是(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。
 还原NO的化学方程式是
还原NO的化学方程式是(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的
 、NO转化为
、NO转化为 、
、 。
。①在碱性条件下,NaClO溶液吸收烟气中
 的离子方程式是
的离子方程式是②一定时间内,温度对硫、硝脱除率的影响曲线如图,
 的脱除率高于NO,可能的原因是
的脱除率高于NO,可能的原因是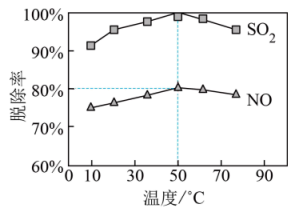
 和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的
和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙的骄傲。黑火药在发生爆炸时,发生如下反应: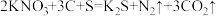 。其中被氧化的元素是
。其中被氧化的元素是___ ,还原产物是___ 。
(2) 与浓
与浓 发生反应:
发生反应: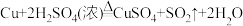 。其中氧化产物为
。其中氧化产物为___ 。若反应中转移电子的物质的量为 ,则生成的
,则生成的 气体在标准状况下的体积
气体在标准状况下的体积__ 。
(3)下列微粒:①S② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ 在化学反应中只能被氧化的是
在化学反应中只能被氧化的是___ (填序号,下同),只能表现出氧化性的是____ 。
(4)配平化学方程式: +
+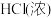 =
= +
+ +
+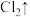 +
+ ,
,___ ,上述反应中物质氧化性:___ >__ ,每生成 时有
时有__ 个电子发生转移,氧化剂与还原剂的物质的量之比为___ 。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙的骄傲。黑火药在发生爆炸时,发生如下反应:
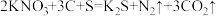 。其中被氧化的元素是
。其中被氧化的元素是(2)
 与浓
与浓 发生反应:
发生反应: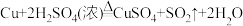 。其中氧化产物为
。其中氧化产物为 ,则生成的
,则生成的 气体在标准状况下的体积
气体在标准状况下的体积(3)下列微粒:①S②
 ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ 在化学反应中只能被氧化的是
在化学反应中只能被氧化的是(4)配平化学方程式:
 +
+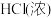 =
= +
+ +
+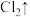 +
+ ,
, 时有
时有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氮及其化合物与生产生活及环境息息相关。请回答下列问题:
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:_____ 。
(2)硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是_____ 。
A.酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
②在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有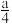 g HNO3被还原,则a:b可能为
g HNO3被还原,则a:b可能为_____ 。
A.2:1 B.3:1 C.4:1 D.9:2
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式_____ ,氧化产物与还原产物的物质的量之比为_____ 。
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(HSbF6),称为超强酸。氟锑酸可由SbF5与HF混合得到。制备氟锑酸一般在塑料容中进行,不在玻璃仪器中进行的原因是_____ (用化学方程式回答)
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:
(2)硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是
A.酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
②在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有
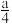 g HNO3被还原,则a:b可能为
g HNO3被还原,则a:b可能为A.2:1 B.3:1 C.4:1 D.9:2
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(HSbF6),称为超强酸。氟锑酸可由SbF5与HF混合得到。制备氟锑酸一般在塑料容中进行,不在玻璃仪器中进行的原因是
您最近一年使用:0次
【推荐1】(1)黑火药是我国古代科技四大发明之一,在化学史上占有重要地位,黑火药主要是硝酸钾、硫磺、木炭三者 粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3+S+C→N2↑+CO2↑+K2S
试填写下列空白:
①在黑火药燃烧的反应中,氧化剂为_____ ,被氧化的物质为_____ 。
②根据化学反应式分析,一个硫原子参与反应时_____ (得到或失去)_______ 个电子。
(2)过氧化氢(H2O2,氧显-1 价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2 =2Ag+O2↑+H2O
B.2H2O2 =2H2O+O2 ↑
C.3H2O2 +Cr2(SO4)3+10KOH=2K2CrO4 +3K2SO4 +8H2O
①上述反应中,H2O2分别表现的性质。A_______ ;B ______ ;C_______ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序_____________ 。
试填写下列空白:
①在黑火药燃烧的反应中,氧化剂为
②根据化学反应式分析,一个硫原子参与反应时
(2)过氧化氢(H2O2,氧显-1 价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2 =2Ag+O2↑+H2O
B.2H2O2 =2H2O+O2 ↑
C.3H2O2 +Cr2(SO4)3+10KOH=2K2CrO4 +3K2SO4 +8H2O
①上述反应中,H2O2分别表现的性质。A
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序
您最近一年使用:0次
【推荐2】ClO2是一种新型消毒剂,以下反应均能制得ClO2。
Ⅰ.2NaCl+6H2O 2ClO2↑+5H2↑+2NaOH
2ClO2↑+5H2↑+2NaOH
Ⅱ.5NaClO3+6HCl=6ClO2↑+3H2O+5NaCl
Ⅲ.Cl2+2NaClO2=2ClO2↑+2NaCl
(1)请表示反应Ⅰ中电子转移的方向和数目___________ 。
(2)由反应②可知,氧化性NaClO3____ ClO2;
(3)通过反应Ⅱ和Ⅲ分别制备标准状况下2.24LClO2,转移电子物质的量之比为___________ 。
(4)从氯元素利用率的角度分析,以上三种方法中,制备ClO2的最佳方法是___________ 。(填序号)
Ⅰ.2NaCl+6H2O
 2ClO2↑+5H2↑+2NaOH
2ClO2↑+5H2↑+2NaOHⅡ.5NaClO3+6HCl=6ClO2↑+3H2O+5NaCl
Ⅲ.Cl2+2NaClO2=2ClO2↑+2NaCl
(1)请表示反应Ⅰ中电子转移的方向和数目
(2)由反应②可知,氧化性NaClO3
(3)通过反应Ⅱ和Ⅲ分别制备标准状况下2.24LClO2,转移电子物质的量之比为
(4)从氯元素利用率的角度分析,以上三种方法中,制备ClO2的最佳方法是
您最近一年使用:0次
【推荐3】KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:_____ KClO3+________ HCl(浓)→_________ KCl+_______ ClO2↑+______ Cl2↑+__________ H2O
(1)请配平该化学方程式(未知系数填入横线内)。
(2)浓盐酸在反应中显示出来的性质是________ (填编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)5 ℃ 下将产物氯气0.1 mol溶于水配成1 L溶液,请写出氯气溶于水的化学反应方程式____________________ 。
(4)若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:______________________________________________ 。
(1)请配平该化学方程式(未知系数填入横线内)。
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)5 ℃ 下将产物氯气0.1 mol溶于水配成1 L溶液,请写出氯气溶于水的化学反应方程式
(4)若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:
您最近一年使用:0次



