马鞍山有丰富的黄铁矿,可用于工业制硫酸,该市硫酸厂可用下列仪器组装一套装置来测定黄铁矿 (主要成分FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)。实验的正确操作步骤如下:

A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L∙min-1的速率鼓入空气
E.将硬质玻璃管中的黄铁矿样品加热到800°C~850°C
F.用300mL的足量饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取、分离
H.取20.00mL G中所得溶液,用0.2000mol/L的NaOH标准溶液滴定。
试回答:
(1)步骤G中所用主要仪器是__________ ,应取__________ (填“上”或“下”)层溶液进行后续实验。
(2)装置正确的连接顺序是____ →____ 一___ →④→____ (填编号)。
(3)装置⑤中KMnO4的作用是_______ 。 若缺少装置⑤,则测定结果会__________ (填“偏大”“偏小”或“不变”)。
(4)步骤H中滴定时一般选用_____ 作指示剂,可以根据________ 现象来判断滴定已经达到终点。
(S)假定黄铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收,滴定得到的数据如下表所示:
则黄铁矿样品中硫元素的质量分数为____________ (保留小数点后1位)。
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置①所得吸收液中加入下列哪种试剂_________________ 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液

A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L∙min-1的速率鼓入空气
E.将硬质玻璃管中的黄铁矿样品加热到800°C~850°C
F.用300mL的足量饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取、分离
H.取20.00mL G中所得溶液,用0.2000mol/L的NaOH标准溶液滴定。
试回答:
(1)步骤G中所用主要仪器是
(2)装置正确的连接顺序是
(3)装置⑤中KMnO4的作用是
(4)步骤H中滴定时一般选用
(S)假定黄铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收,滴定得到的数据如下表所示:
| 滴定次数 | 待测液的体积/mL | NaOH标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00 | 0.00 | 20.48 |
| 第二次 | 20.00 | 0.22 | 20.20 |
| 第三次 | 20.00 | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置①所得吸收液中加入下列哪种试剂
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
更新时间:2020-09-12 22:25:08
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚硫酸钠和硫代硫酸钠(Na2S2O3)都是重要的含硫化合物。某化学兴趣小组进行以下有关实验,填写下列空白。
实验Ⅰ:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有___________ (填标号)。
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是___________ 。
实验Ⅱ:制取硫代硫酸钠
利用如图所示装置进行实验___________ 。
(3)装置D的作用是___________ 。
(4)实验中,为使 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是___________ 。
实验Ⅲ:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品7.9g,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用0.1mol·L-1I2标准溶液滴定(发生反应:2S2O +I2=S4O
+I2=S4O +2I-),至滴定终点共消耗标准溶液23.60mL。
+2I-),至滴定终点共消耗标准溶液23.60mL。
(5)样品中Na2S2O3的百分含量为___________ (保留三位有效数字)。
实验Ⅰ:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是
实验Ⅱ:制取硫代硫酸钠
利用如图所示装置进行实验
(3)装置D的作用是
(4)实验中,为使
 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是实验Ⅲ:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品7.9g,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用0.1mol·L-1I2标准溶液滴定(发生反应:2S2O
 +I2=S4O
+I2=S4O +2I-),至滴定终点共消耗标准溶液23.60mL。
+2I-),至滴定终点共消耗标准溶液23.60mL。(5)样品中Na2S2O3的百分含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:___________ ;
(2)过程②对应的化学方程式是:___________ 。
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2 +I2=
+I2= +2I-)
+2I-)
iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是_________ ;
(4)醋酸铜产品中铜元素的质量分数是_______ 。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:
(2)过程②对应的化学方程式是:
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2
 +I2=
+I2= +2I-)
+2I-)iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是
(4)醋酸铜产品中铜元素的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】H2O2可降解废水中的有机物,活性炭(AC)能促进H2O2分解产生羟基自由基(·OH),提高对水中有机化合物的降解率。实验表明,AC表面的酸碱性会影响H2O2的分解反应。实验室中,将纯化的AC在氮气(60mL·min-1)和氨气(20mL·min-1)气氛中于650℃下热处理2h可制得氨气改性活性炭(ACN)。回答下列问题:
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6h除去灰分,用蒸馏水洗涤至中性。研磨的目的是___ 。为了防止放置过程中再次吸水,烘干后的AC应置于干燥器中备用。
(2)制备ACN:

检查装置气密性并加入药品后,加热前应进行的操作是通入氮气,其目的是___ ;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为___ 。U形管b内试剂B的作用是___ 。
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入ACN0.5g,加入0.05mol·L-1的X溶液amL。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1mol·L-1的标准盐酸滴定剩余的X溶液,标准盐酸的平均用量为bmL。则X为___ (填“NaOH”、“Na2CO3”或“NaHCO3”),计算所得活性炭表面的羧基含量为___ mol·kg-1(已知:ACN中,羧基的Ka=1.0×10-4,酚羟基的Ka=5.0×10-9;碳酸的Ka1=4.2×10-7、Ka2=5.6×10-11;用含a、b的代数式表示)。
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6h除去灰分,用蒸馏水洗涤至中性。研磨的目的是
(2)制备ACN:

检查装置气密性并加入药品后,加热前应进行的操作是通入氮气,其目的是
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入ACN0.5g,加入0.05mol·L-1的X溶液amL。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1mol·L-1的标准盐酸滴定剩余的X溶液,标准盐酸的平均用量为bmL。则X为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
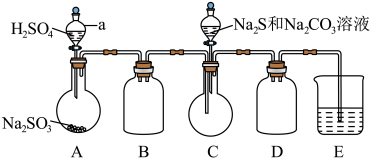
【推荐1】某兴趣小组设计如下装置进行铜与硝酸反应的实验,以探究化学实验的绿色化。
(1)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
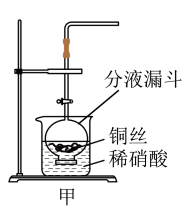
①写出铜与稀硝酸反应的离子方程式_____________ 。
②实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是_______ (填序号)。
A.铁 B.铝 C.铂 D.玻璃
③打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是___________ (用化学方程式表示)。
(2)为证明铜丝与稀硝酸反应生成的气体确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
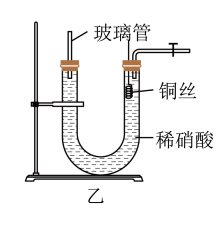
①长玻璃管的作用是_______________________________________ 。
②为证明铜丝与稀硝酸反应产生的气体确实是NO,实验前的关键操作是__________ 。
(3)将32.64g铜与140mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
NO的物质的量为______________ ,硝酸的浓度为_______________ (取三位有效数字)。
(1)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①写出铜与稀硝酸反应的离子方程式
②实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是
A.铁 B.铝 C.铂 D.玻璃
③打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是
(2)为证明铜丝与稀硝酸反应生成的气体确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。

①长玻璃管的作用是
②为证明铜丝与稀硝酸反应产生的气体确实是NO,实验前的关键操作是
(3)将32.64g铜与140mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
NO的物质的量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg/L左右。交中学生的化学竞赛团队曾对某品牌橙汁的Vc含量做了测定,方法与过程大致如下:
①洗涤仪器,检查滴定管是否漏液。润洗后装好标准碘溶液待用。
②向锥形瓶中加入20.00mL待测橙汁(橙黄色),滴入2滴指示剂______。
③用0.007500mol/L的标准碘溶液滴定橙汁。滴定过程中,一手控制滴定管的_________,一手摇晃锥形瓶,眼睛观察___________________________。
反应方程式为:I2+C6H8O6→C6H6O6+2HI
④滴定终点的现象是____________。
⑤消耗标准碘溶液15mL。
(1)根据碘单质特有的性质,本实验应选用_____ 为指示剂。
(2)滴定过程中,一手控制滴定管的___ ,一手摇晃锥形瓶,眼睛观察_______ 。
(3)滴定终点的现象是________ 。
(4)量取20.00mL待测橙汁的实验仪器____ (填“是”或“不是”)量筒。根据实验仪器不同精确度的要求,消耗标准碘溶液15mL中的“15”应修改为_____ mL。
(5)此橙汁中维生素C的含量是___ mg/L。从分析数据看,此橙汁__ 纯天然橙汁(填“是”或“不是”)。
(6)制造商可能采取的做法是________________ 。
①洗涤仪器,检查滴定管是否漏液。润洗后装好标准碘溶液待用。
②向锥形瓶中加入20.00mL待测橙汁(橙黄色),滴入2滴指示剂______。
③用0.007500mol/L的标准碘溶液滴定橙汁。滴定过程中,一手控制滴定管的_________,一手摇晃锥形瓶,眼睛观察___________________________。
反应方程式为:I2+C6H8O6→C6H6O6+2HI
④滴定终点的现象是____________。
⑤消耗标准碘溶液15mL。
(1)根据碘单质特有的性质,本实验应选用
(2)滴定过程中,一手控制滴定管的
(3)滴定终点的现象是
(4)量取20.00mL待测橙汁的实验仪器
(5)此橙汁中维生素C的含量是
(6)制造商可能采取的做法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】硫酸亚铁铵晶体[ ][
][ ]是常见的补血剂。
]是常见的补血剂。
已知:
①硫酸亚铁铵晶体在空气中不易被氧化。
② 溶液与
溶液与 反应可得到硫酸亚铁铵。
反应可得到硫酸亚铁铵。
(1) 溶液的制备。将铁粉、一定量
溶液的制备。将铁粉、一定量 溶液反应制得
溶液反应制得 溶液,其中加入的铁粉需过量,除铁粉不纯外,主要原因是
溶液,其中加入的铁粉需过量,除铁粉不纯外,主要原因是___________ (用离子方程式表示)。
制备 。向制备得到的
。向制备得到的 溶液中加入一定质量的
溶液中加入一定质量的 固体,在70℃-80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
固体,在70℃-80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
(2)产品化学式的确定 含量的测定
含量的测定

Ⅰ.准确称取58.80g晶体,加水溶解后,将溶液注入三颈烧瓶中;
Ⅱ.准确量取50.00mL 3.030
 溶液于锥形瓶中;
溶液于锥形瓶中;
Ⅲ.向三颈烧瓶中通入氮气,加入足量NaOH浓溶液,加热,蒸氨结束后取下锥形瓶;
Ⅳ.用0.120 的NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mLNaOH标准溶液。
的NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mLNaOH标准溶液。
①装置M的名称为___________ 。
②通入 的作用为
的作用为___________ 。
③步骤Ⅲ中,反应的离子方程式是___________ 。
④若步骤Ⅳ中,未用NaOH标准溶液润洗滴定管,则 将
将___________ (填“偏大”、“偏小”或“不变”)。步骤Ⅳ中,滴定时还必须选用的仪器是___________ (填编号)。

(3)产品化学式的确定 含量的测定
含量的测定
Ⅰ.另准确称取58.80g晶体于烧杯中,加水溶解,边搅拌边加入过量的 溶液;
溶液;
Ⅱ.将得到的溶液过滤得到沉淀,洗涤沉淀3~4次;
Ⅲ.灼烧沉淀至恒重,称量,得沉淀质量为69.90g。
结合实验(3)和(4),通过计算得出硫酸亚铁铵晶体的化学式为___________ 。
 ][
][ ]是常见的补血剂。
]是常见的补血剂。已知:
①硫酸亚铁铵晶体在空气中不易被氧化。
②
 溶液与
溶液与 反应可得到硫酸亚铁铵。
反应可得到硫酸亚铁铵。(1)
 溶液的制备。将铁粉、一定量
溶液的制备。将铁粉、一定量 溶液反应制得
溶液反应制得 溶液,其中加入的铁粉需过量,除铁粉不纯外,主要原因是
溶液,其中加入的铁粉需过量,除铁粉不纯外,主要原因是制备
 。向制备得到的
。向制备得到的 溶液中加入一定质量的
溶液中加入一定质量的 固体,在70℃-80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
固体,在70℃-80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。(2)产品化学式的确定
 含量的测定
含量的测定
Ⅰ.准确称取58.80g晶体,加水溶解后,将溶液注入三颈烧瓶中;
Ⅱ.准确量取50.00mL 3.030

 溶液于锥形瓶中;
溶液于锥形瓶中;Ⅲ.向三颈烧瓶中通入氮气,加入足量NaOH浓溶液,加热,蒸氨结束后取下锥形瓶;
Ⅳ.用0.120
 的NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mLNaOH标准溶液。
的NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mLNaOH标准溶液。①装置M的名称为
②通入
 的作用为
的作用为③步骤Ⅲ中,反应的离子方程式是
④若步骤Ⅳ中,未用NaOH标准溶液润洗滴定管,则
 将
将
(3)产品化学式的确定
 含量的测定
含量的测定Ⅰ.另准确称取58.80g晶体于烧杯中,加水溶解,边搅拌边加入过量的
 溶液;
溶液;Ⅱ.将得到的溶液过滤得到沉淀,洗涤沉淀3~4次;
Ⅲ.灼烧沉淀至恒重,称量,得沉淀质量为69.90g。
结合实验(3)和(4),通过计算得出硫酸亚铁铵晶体的化学式为
您最近一年使用:0次
【推荐1】某实验小组设计用 50mL 0.50mol·L-1盐酸和50mL 0.55mol·L-1氢氧化钠溶液在如图1装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。
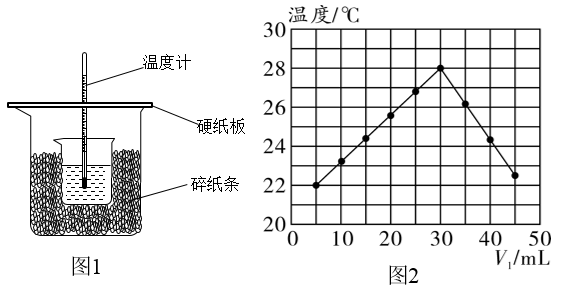
(1)在大小烧杯之间填充碎泡沫塑料的主要作用是___________ 。
(2)从实验装置上看,图1中尚缺少的一种玻璃用品是:___________ 。
(3)若改用 60mL 0.50mol·L-1盐酸和 50mL 0.55mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量___________ (填“增加”、“减少”或“不变”,下同),所求中和热数值___________ 。
(4)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1,为了计算中和热,某学生实验数据记录如表:
平均温度差是___________ ℃,该实验测得的中和热ΔH=___________ kJ·mol-1(结果精确到0.1)。
(5)在中和热测定实验中,若用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,则测得的中和热数值___________ (填“偏大”“偏小”或“不变”)。
(6)实验小组另取V1mL0.50mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL)。则实验小组做该实验时的环境温度___________ (填“高于”“低于”或“等于”)22℃,NaOH溶液的浓度为___________ mol·L-1。

(1)在大小烧杯之间填充碎泡沫塑料的主要作用是
(2)从实验装置上看,图1中尚缺少的一种玻璃用品是:
(3)若改用 60mL 0.50mol·L-1盐酸和 50mL 0.55mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量
(4)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1,为了计算中和热,某学生实验数据记录如表:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20 | 20.1 | 23 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
(5)在中和热测定实验中,若用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,则测得的中和热数值
(6)实验小组另取V1mL0.50mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL)。则实验小组做该实验时的环境温度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,该小组设计的简易实验装置如图所示:
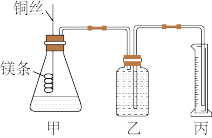
该实验的主要操作步骤如下:
①用___ (填仪器名称)配制100mL、1.0mol·L-1的盐酸;
②量取10.0mL1.0mol·L-1的盐酸加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为___ ;
④往广口瓶中装入足量水,按图连接好装置,检查装置的气密性;再将镁条全部浸入盐酸中。
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)实验步骤④中检查装置气密性的方法是___ 。
(2)实验步骤⑤中应选用___ 的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意___ 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积Vm=___ ;若未除去镁条表面的氧化膜,则测量结果___ (填“偏大”、“偏小”或“无影响”)。

该实验的主要操作步骤如下:
①用
②量取10.0mL1.0mol·L-1的盐酸加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为
④往广口瓶中装入足量水,按图连接好装置,检查装置的气密性;再将镁条全部浸入盐酸中。
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)实验步骤④中检查装置气密性的方法是
(2)实验步骤⑤中应选用
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积Vm=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中装置是用燃烧法确定有机物分子式常用的装置。

①产生的氧气按从左到右的流向,所选装置各导管的连接顺序是_______ 。
②C装置中浓H2SO4的作用是_______ 。
③D装置中MnO2的作用是_______ 。
④燃烧管中CuO的作用是_______ 。
⑤0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为_______ 。

①产生的氧气按从左到右的流向,所选装置各导管的连接顺序是
②C装置中浓H2SO4的作用是
③D装置中MnO2的作用是
④燃烧管中CuO的作用是
⑤0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为
您最近一年使用:0次

 0
0

