某课外小组对一些金属单质和化合物的性质进行研究。
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应________________________ ,化合反应________________________ .
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡,持续电解,在阴极附近的溶液中还可观察到的现象是________________________ ,解释此现象的离子方程式是____________________ 。
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是___________________ 。
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:______________ 。
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色 |
置换反应
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡,持续电解,在阴极附近的溶液中还可观察到的现象是
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:
20-21高一·全国·课时练习 查看更多[1]
(已下线)第二节 金属材料(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)
更新时间:2020-09-22 02:45:32
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成分,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________ 。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___ ,反应的离子方程式为_____ 。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___ (填“正确”或“不正确”),理由是(用离子方程式表示)______________________ 。
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______ 。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________ 。
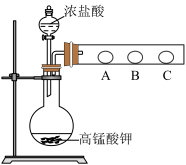
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______ (填“能”或“不能”),理由是______________ 。

(1)甲同学想探究“铝热反应”中熔融物的成分,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有

(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】锂被誉为“高能金属”,废旧锂离子电池的正极材料主要含有LiCoO2及少量Al、Fe等,处理该废料的一种工艺流程如图所示:
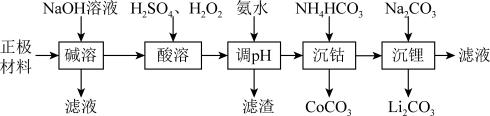
已知:①Ksp(Li2CO3)=1.6×10-3,LiCoO2难溶于水,具有强氧化性;
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:____________________________________ 。
(2)为提高“酸溶”的浸出速率,可采取的措施有___________________________ (任写一种)。
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为_____________________________ ;若用浓盐酸代替H2SO4和H2O2的混合液,缺点是___________________________________ 。
(4)用氨水调节pH的范围为____________ ,若“沉钴”后溶液中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,沉淀中的Li元素占原Li元素总量的90%,则“沉锂”后溶液中c( )=
)=__________ mol·L-1。
(5)该流程涉及多次过滤,实验室中过滤后洗涤沉淀的操作为________________ 。
(6)写出“沉钴”过程中发生反应的离子方程式:____________________________________ 。

已知:①Ksp(Li2CO3)=1.6×10-3,LiCoO2难溶于水,具有强氧化性;
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.0 |
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:
(2)为提高“酸溶”的浸出速率,可采取的措施有
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为
(4)用氨水调节pH的范围为
 )=
)=(5)该流程涉及多次过滤,实验室中过滤后洗涤沉淀的操作为
(6)写出“沉钴”过程中发生反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
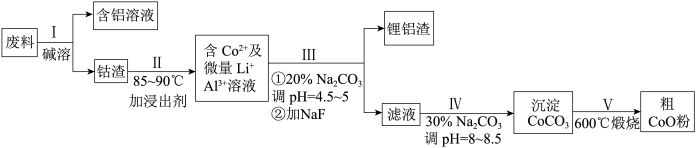
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为_______ 。
(2)过程II中先加入稀H2SO4酸化,再加入Na2S2O3溶液,则浸出钴的化学反应方程式为(产物中只有一种酸根)_______ 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,则不用盐酸的主要原因是_______ 。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是_______ 。
(4)仅从沉淀转化角度考虑,能否利用反应:CoCO3+C2O
 CoC2O4+CO
CoC2O4+CO 将CoCO3转化为CoC2O4?
将CoCO3转化为CoC2O4?_______ (填“能”或“不能”),说明理由:_______ 。[已知Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8]。
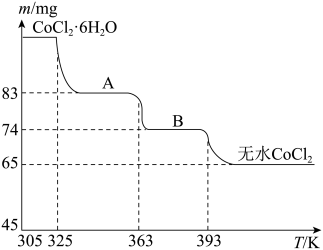
(5)CoO溶于盐酸得粉红色CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色CoCl2·6H2O晶体受热时,剩余固体质量随温度变化的曲线,A物质的化学式是_______ 。

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为
(2)过程II中先加入稀H2SO4酸化,再加入Na2S2O3溶液,则浸出钴的化学反应方程式为(产物中只有一种酸根)
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是
(4)仅从沉淀转化角度考虑,能否利用反应:CoCO3+C2O

 CoC2O4+CO
CoC2O4+CO 将CoCO3转化为CoC2O4?
将CoCO3转化为CoC2O4?(5)CoO溶于盐酸得粉红色CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色CoCl2·6H2O晶体受热时,剩余固体质量随温度变化的曲线,A物质的化学式是

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。经过一定条件的转化二者均可转化为金属单质,根据下列框图转化回答问题:
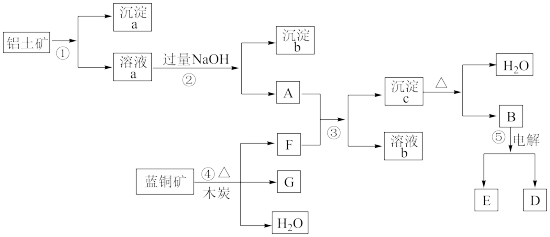
(1)写出①的离子方程式:______________________ 、_____________________ 。
(2)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:
________________________________ 、_________________________________ 。
(3)若过量F与A反应,溶液b的成分是:_____________ (写化学式)。

(1)写出①的离子方程式:
(2)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:
(3)若过量F与A反应,溶液b的成分是:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】某研究性学习小组拟探究热CuCl2·2H2O的热稳定性,进行如下操作:
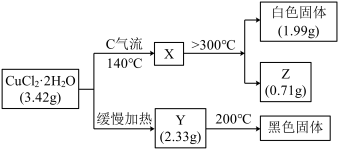
上述所列物质都是纯净物,请回答:
(1)气流C的结构式______ ,白色固体的化学式________ 。
(2)已知Y的摩尔质量为233 g·mol-1,完成CuCl2·2H2O缓慢加热分解的化学方程式__________ 。

上述所列物质都是纯净物,请回答:
(1)气流C的结构式
(2)已知Y的摩尔质量为233 g·mol-1,完成CuCl2·2H2O缓慢加热分解的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】二草酸合铜(Ⅱ)酸钾( )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是________ (填仪器名称)。

(2)长期存放的 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是________ 。
(3)Ⅰ中的黑色沉淀是________ (写化学式)。
(4)Ⅱ中原料配比为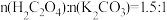 ,写出反应的化学方程式
,写出反应的化学方程式________ 。
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入 应采取
应采取________ 的方法。
(6)Ⅲ中应采用________ 进行加热。
(7)Ⅳ中“一系列操作”包括________ 。
 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由
 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
(2)长期存放的
 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是(3)Ⅰ中的黑色沉淀是
(4)Ⅱ中原料配比为
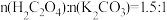 ,写出反应的化学方程式
,写出反应的化学方程式(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入
 应采取
应采取(6)Ⅲ中应采用
(7)Ⅳ中“一系列操作”包括
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】I.某化学兴趣小组为探究 的性质,按照如图所示装置进行实验,请回答下列问题
的性质,按照如图所示装置进行实验,请回答下列问题
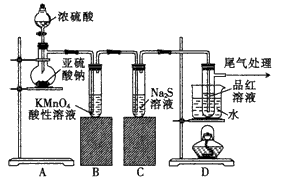
(1) 实验中装置B发生的反应的现象是________ 并写出相应的化学方程式________
(2)反应开始一段时间后,观察到D装置试管中的品红溶液_______ ,停止通气,再对试管加热,其现象为___________ ,若将 直接通入品红溶液待褪色后再加热其现象是否与上述相同
直接通入品红溶液待褪色后再加热其现象是否与上述相同__________ 。(填“相同”或“不相同”)
(3)能说明 的非金属性比S的非金属性强的事实是
的非金属性比S的非金属性强的事实是_____
A.向 的水溶液中通入
的水溶液中通入 后出现浑浊
后出现浑浊
B.Cl原子最外层有7个电子,而S原子最外层有6个电子
C.HCl水溶液的酸性强于 水溶液的酸性
水溶液的酸性
D. 的酸性比
的酸性比 的酸性强
的酸性强
(4)尾气可采用_________ 溶液吸收。
II. 是一种常见的碱性气体,在化工生产中有着广泛的应用。
是一种常见的碱性气体,在化工生产中有着广泛的应用。
(5)氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:
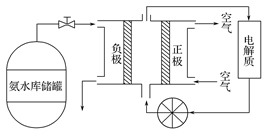
氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应式是________ ,正极的电极反应式是____________
 的性质,按照如图所示装置进行实验,请回答下列问题
的性质,按照如图所示装置进行实验,请回答下列问题
(1) 实验中装置B发生的反应的现象是
(2)反应开始一段时间后,观察到D装置试管中的品红溶液
 直接通入品红溶液待褪色后再加热其现象是否与上述相同
直接通入品红溶液待褪色后再加热其现象是否与上述相同(3)能说明
 的非金属性比S的非金属性强的事实是
的非金属性比S的非金属性强的事实是A.向
 的水溶液中通入
的水溶液中通入 后出现浑浊
后出现浑浊B.Cl原子最外层有7个电子,而S原子最外层有6个电子
C.HCl水溶液的酸性强于
 水溶液的酸性
水溶液的酸性D.
 的酸性比
的酸性比 的酸性强
的酸性强(4)尾气可采用
II.
 是一种常见的碱性气体,在化工生产中有着广泛的应用。
是一种常见的碱性气体,在化工生产中有着广泛的应用。(5)氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:

氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】自来水厂常用氯气来杀菌消毒,某班学生对氯气的制取、性质进行如下探究。
【查阅资料】氯气( )是黄绿色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成盐酸和次氯酸(HClO)。
)是黄绿色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成盐酸和次氯酸(HClO)。
【探究一】制取氯气:实验室常用二氧化锰固体和浓盐酸加热制取氯气,反应原理为: 。
。
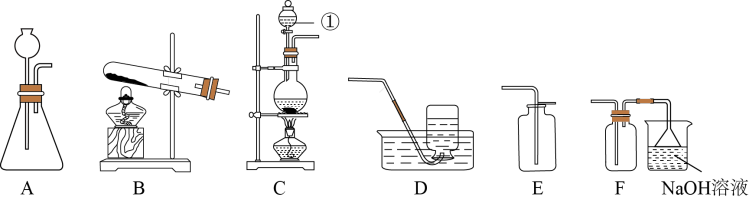
(1)下图中仪器①的名称是_______ ,实验室制取氯气应选择的发生装置是_______ (填序号),最佳收集装置是_______ (填序号)。
(2)若实验时使用的17.4g 完全反应,则反应产生的
完全反应,则反应产生的 在标准状况下的体积为
在标准状况下的体积为_______ 。
【探究二】氯气的性质
(3)小明用如图装置探究氯气的漂白性:
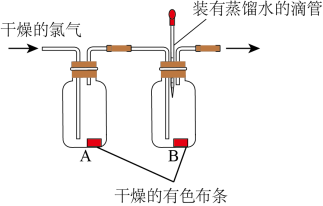
实验步骤:
Ⅰ.将滴管内的蒸馏水滴到B瓶中的干燥有色布条上,布条没有褪色;
Ⅱ.通入干燥的 ,发现A瓶中的布条没有褪色,而B瓶中的布条褪色。
,发现A瓶中的布条没有褪色,而B瓶中的布条褪色。
①通过上述实验,小明能得到的结论是_______ 。
②小颖根据查阅的资料信息,补充做了一个实验:_______ (写出实验步骤和现象),从而得出“次氯酸具有漂白性”的结论。
③小明同学认为,如图实验装置中有一个明显的缺陷,该装置的不足之处是_______ 。
(4)小星用如图装置探究氯气的助燃性:

实验步骤:
Ⅰ.用锌粒和稀硫酸在C装置中制取氢气;
Ⅱ.先_______ ,然后再点燃氢气,产生淡蓝色火焰;
Ⅲ.将燃着的氢气导管缓缓伸到装满氯气的集气瓶D中,观察到氢气继续燃烧并产生苍白色火焰。请写出该反应的化学方程式:_______ 。
实验反思:小星发现氢气在氯气中燃烧时,集气瓶D瓶口上方有大量白雾,你认为产生白雾的可能原因是_______ 。
【查阅资料】氯气(
 )是黄绿色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成盐酸和次氯酸(HClO)。
)是黄绿色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成盐酸和次氯酸(HClO)。【探究一】制取氯气:实验室常用二氧化锰固体和浓盐酸加热制取氯气,反应原理为:
 。
。(1)下图中仪器①的名称是

(2)若实验时使用的17.4g
 完全反应,则反应产生的
完全反应,则反应产生的 在标准状况下的体积为
在标准状况下的体积为【探究二】氯气的性质
(3)小明用如图装置探究氯气的漂白性:

实验步骤:
Ⅰ.将滴管内的蒸馏水滴到B瓶中的干燥有色布条上,布条没有褪色;
Ⅱ.通入干燥的
 ,发现A瓶中的布条没有褪色,而B瓶中的布条褪色。
,发现A瓶中的布条没有褪色,而B瓶中的布条褪色。①通过上述实验,小明能得到的结论是
②小颖根据查阅的资料信息,补充做了一个实验:
③小明同学认为,如图实验装置中有一个明显的缺陷,该装置的不足之处是
(4)小星用如图装置探究氯气的助燃性:

实验步骤:
Ⅰ.用锌粒和稀硫酸在C装置中制取氢气;
Ⅱ.先
Ⅲ.将燃着的氢气导管缓缓伸到装满氯气的集气瓶D中,观察到氢气继续燃烧并产生苍白色火焰。请写出该反应的化学方程式:
实验反思:小星发现氢气在氯气中燃烧时,集气瓶D瓶口上方有大量白雾,你认为产生白雾的可能原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质。甲同学设计了如图所示的实验装置(注:氯气可溶于四氯化碳溶液)。
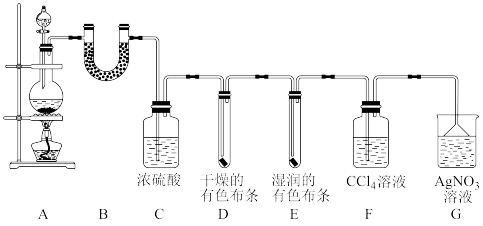
请按要求回答下列问题:
(1)若用0.2mol的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12L(标准状况下)的原因是___________ 。
(2)①装置B中盛放的试剂为无水硫酸铜,其作用是___________ ,现象是___________ 。
②装置D和E中出现的不同现象说明的问题是___________ 。
③写出装置G中发生反应的离子方程式___________ 。
(3)乙同学认为甲同学设计的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在___________ 与___________ 之间(填字母),装置中应放入___________ (填试剂或药品名称)。

请按要求回答下列问题:
(1)若用0.2mol的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12L(标准状况下)的原因是
(2)①装置B中盛放的试剂为无水硫酸铜,其作用是
②装置D和E中出现的不同现象说明的问题是
③写出装置G中发生反应的离子方程式
(3)乙同学认为甲同学设计的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
您最近一年使用:0次



