Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料。也可用于镍粉的制造,其一种生产工艺如图。

有关氢氧化物开始沉淀和沉淀完全的pH如表:
(1)Ni2O3中Ni的化合价为___ 。
(2)“酸浸”时温度不宜过高的原因是__ 。
(3)加入H2O2“氧化”的目的是__ 。加入Na2CO3溶液调节溶液pH的范围为__ 。
(4)从滤液A中可回收利用的主要物质是__ 。
(5)加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为__ 。
(6)为测定样品中Ni2O3的质量分数。进行实验;称取5.000g样品。加入足量硫酸后再加入100mL1.0mol·L-1的Fe2+标准溶液。充分反应。加水定容至200mL.取出20.00mL。用0.040mol·L-1KMnO4标准溶液滴定。用去KMnO4标准溶液20.00mL。试通过计算确定Ni2O3的质量分数__ 。测定过程中涉及的反应如下:Ni2O3+2Fe2++6H+=2Ni2++2Fe3++3H2O;5Fe2++MnO +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀时pH | 1.5 | 6.5 | 7.1 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.1 |
(2)“酸浸”时温度不宜过高的原因是
(3)加入H2O2“氧化”的目的是
(4)从滤液A中可回收利用的主要物质是
(5)加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为
(6)为测定样品中Ni2O3的质量分数。进行实验;称取5.000g样品。加入足量硫酸后再加入100mL1.0mol·L-1的Fe2+标准溶液。充分反应。加水定容至200mL.取出20.00mL。用0.040mol·L-1KMnO4标准溶液滴定。用去KMnO4标准溶液20.00mL。试通过计算确定Ni2O3的质量分数
 +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。
更新时间:2020-10-04 19:24:01
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】工业以炼钢废渣(主要含 还有
还有 等杂质)为原料制备脱硫剂活性
等杂质)为原料制备脱硫剂活性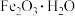 ,并用该脱硫剂处理沼气中
,并用该脱硫剂处理沼气中 的流程如下:
的流程如下:__________________ (写出两条即可)。
(2)滤渣1的成分有__________________ 。
(3)写出“还原”时发生反应的离子的离子符号__________________ 。
(4)加热条件下滤渣2可与浓硫酸反应生成一种气体,请写出该气体的电子式__________________ 。
(5)写出“沉铁”时生成 沉淀的离子方程式
沉淀的离子方程式__________________ 。
(6)“脱硫Ⅰ、再生Ⅱ”的原理如图所示。 ,原因是
,原因是__________________ 。在整个过程中当有 完全反应时理论上能处理标况下
完全反应时理论上能处理标况下
__________________ L。
 还有
还有 等杂质)为原料制备脱硫剂活性
等杂质)为原料制备脱硫剂活性 ,并用该脱硫剂处理沼气中
,并用该脱硫剂处理沼气中 的流程如下:
的流程如下:
(2)滤渣1的成分有
(3)写出“还原”时发生反应的离子的离子符号
(4)加热条件下滤渣2可与浓硫酸反应生成一种气体,请写出该气体的电子式
(5)写出“沉铁”时生成
 沉淀的离子方程式
沉淀的离子方程式(6)“脱硫Ⅰ、再生Ⅱ”的原理如图所示。

 ,原因是
,原因是 完全反应时理论上能处理标况下
完全反应时理论上能处理标况下
您最近一年使用:0次
【推荐2】无水氯化钴(CoCl2)用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO,含少量NiO、CuO、FeO和SiO2等)为原料制备无水氯化钴的工艺流程如图:

已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题
(1)固体1的主要成分是__ (填化学式)。
(2)从绿色化学角度考虑选择试剂M,其作用是__ (用离子方程式表示)。调pH=6.5的目的是__ 。
(3)“萃取”目的是除去__ (填离子符号)。R代表被萃取的离子,萃取过程简化为:R2(SO4)x(水层)+2xHA(有机层) 2RAx(有机层)+xH2SO4(水层)。为了提高萃取率,宜采取措施有
2RAx(有机层)+xH2SO4(水层)。为了提高萃取率,宜采取措施有__ (答一条即可)。
(4)“灼烧”发生的化学方程式为__ 。
(5)室温下,“沉钴”过程中,当c(CO )=1.4×10-6mol•L-1时,c(Co2+)=1.0×10-7mol•L-1。则在室温下,Ksp(CoCO3)=
)=1.4×10-6mol•L-1时,c(Co2+)=1.0×10-7mol•L-1。则在室温下,Ksp(CoCO3)=__ 。
(6)测定CoCl2产品纯度:准确称取mg产品溶于蒸馏水配制成250mL溶液,量取25.00mL所配制溶液于锥形瓶中,加入几滴K2CrO4溶液作指示剂,用cmol•L-1AgNO3滴定至终点,消耗滴定液体积为xmL。该产品纯度为__ (用含m、c和x的代数式表示)。

已知几种金属氢氧化物沉淀的pH如表所示:
| 金属离子 | 开始沉淀时pH | 完全沉淀时pH |
| Co2+ | 7.6 | 9.2 |
| Cu2+ | 4.4 | 6.4 |
| Ni2+ | 6.8 | 8.4 |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.5 |
请回答下列问题
(1)固体1的主要成分是
(2)从绿色化学角度考虑选择试剂M,其作用是
(3)“萃取”目的是除去
 2RAx(有机层)+xH2SO4(水层)。为了提高萃取率,宜采取措施有
2RAx(有机层)+xH2SO4(水层)。为了提高萃取率,宜采取措施有(4)“灼烧”发生的化学方程式为
(5)室温下,“沉钴”过程中,当c(CO
 )=1.4×10-6mol•L-1时,c(Co2+)=1.0×10-7mol•L-1。则在室温下,Ksp(CoCO3)=
)=1.4×10-6mol•L-1时,c(Co2+)=1.0×10-7mol•L-1。则在室温下,Ksp(CoCO3)=(6)测定CoCl2产品纯度:准确称取mg产品溶于蒸馏水配制成250mL溶液,量取25.00mL所配制溶液于锥形瓶中,加入几滴K2CrO4溶液作指示剂,用cmol•L-1AgNO3滴定至终点,消耗滴定液体积为xmL。该产品纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】市政污泥含大量金属(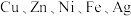 等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(
等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾( )的工艺流程如下:
)的工艺流程如下:
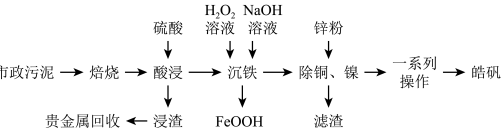
已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有___________ (任写一条)。
(2)“一系列操作”主要包括___________ 、___________ 、过滤、洗涤、干燥。
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为___________ 。
(4)“浸渣”中含有 ,经一系列处理得
,经一系列处理得 {可溶于水,电离成
{可溶于水,电离成 和
和 },用肼(N2H4),还原
},用肼(N2H4),还原 得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:
得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:___________ ,则反应中氧化剂与还原剂的物质的量之比为___________ 。
(5)浸出液中含有 ,“沉铁”步骤中发生反应的离子方程式为
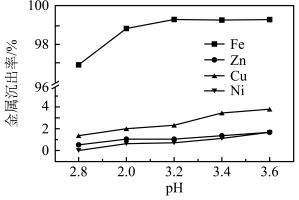
,“沉铁”步骤中发生反应的离子方程式为___________ 。pH对不同金属沉出率的影响如图所示,在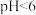 时,
时,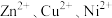 在溶液中以离子形式存在,但是有铁离子存在时,pH升高,
在溶液中以离子形式存在,但是有铁离子存在时,pH升高, 损失率均升高,原因可能是
损失率均升高,原因可能是___________ 。
 等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(
等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾( )的工艺流程如下:
)的工艺流程如下:
已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)“一系列操作”主要包括
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含
 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为(4)“浸渣”中含有
 ,经一系列处理得
,经一系列处理得 {可溶于水,电离成
{可溶于水,电离成 和
和 },用肼(N2H4),还原
},用肼(N2H4),还原 得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:
得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:(5)浸出液中含有
 ,“沉铁”步骤中发生反应的离子方程式为
,“沉铁”步骤中发生反应的离子方程式为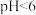 时,
时,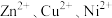 在溶液中以离子形式存在,但是有铁离子存在时,pH升高,
在溶液中以离子形式存在,但是有铁离子存在时,pH升高, 损失率均升高,原因可能是
损失率均升高,原因可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室用酸性蚀刻废液(含Cu2+、H+、CuCl 、Cl-等)和碱性蚀刻废液[NH
、Cl-等)和碱性蚀刻废液[NH 、Cu(NH3)
、Cu(NH3) 、NH3·H2O等]制备CuI(白色固体,难溶于水)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体,难溶于水)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其Cu(NH3) 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为__________ 。
(2)步骤Ⅳ需控制pH为1~2,80℃下进行,加热温度不能过高的原因是__________ 。
(3)步骤Ⅴ目的是制备纯净的硫酸铜晶体,具体步骤是80℃下蒸发浓缩、__________ 。步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

(4)装置c中搅拌的目的是:①加快反应速率,②__________ 。
(5)实验结束后,制得的CuI固体过滤后用装置d所得溶液来洗涤,目的是__________ ,然后再用无水乙醇洗涤。
 、Cl-等)和碱性蚀刻废液[NH
、Cl-等)和碱性蚀刻废液[NH 、Cu(NH3)
、Cu(NH3) 、NH3·H2O等]制备CuI(白色固体,难溶于水)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体,难溶于水)的实验流程如下:
(1)步骤Ⅰ中发生了多个反应,其Cu(NH3)
 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为(2)步骤Ⅳ需控制pH为1~2,80℃下进行,加热温度不能过高的原因是
(3)步骤Ⅴ目的是制备纯净的硫酸铜晶体,具体步骤是80℃下蒸发浓缩、

(4)装置c中搅拌的目的是:①加快反应速率,②
(5)实验结束后,制得的CuI固体过滤后用装置d所得溶液来洗涤,目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
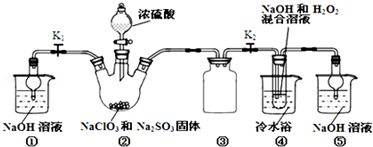
【推荐2】亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
完成下列填空:
(1)装置②中产生ClO2的化学方程式为______ .装置③的作用是______ .
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②______ ;③______ ;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤
D.冰水洗涤 E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是______ ;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为________________________________ .重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL.该样品中NaClO2的质量分数为______ .
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > .______ (填化学式)

完成下列填空:
(1)装置②中产生ClO2的化学方程式为
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤
D.冰水洗涤 E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > .
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是_______ (填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
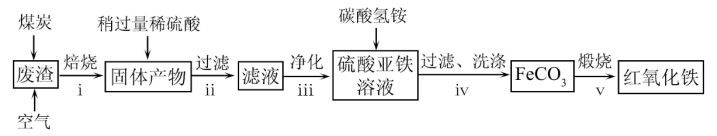
(2)从硫酸工业废渣(主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%)中提取红氧化铁(Fe2O3)的工艺流程如图(部分操作和条件略):
回答下列问题:
①在步骤i焙烧的目的是_______ 。步骤ii的滤渣为_______ 。
②在步骤iii操作中,滴加氨水除Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5 mol·L-1,则溶液的pH为_______ 。
③在步骤iv中发生的反应中有一种气态产物,它是_______ (写化学式)。
④步骤v中,发生反应的化学方程式为_______ 。
(3)工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4),可降低生产成本且产品质量优。工艺流程如下:
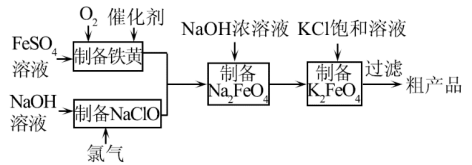
①由图知需先制得高铁酸钠溶液,然后加入饱和KCl溶液转化为高铁酸钾,说明相同温度下溶解度:高铁酸钾_______ 高铁酸钠(填“>”或“<”)。
②写出由铁黄制备高铁酸钠的离子方程式_______ 。
③高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。放电时电池的正极反应式为
3Zn(OH)2+2Fe(OH)3+4KOH。放电时电池的正极反应式为_______ 。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)从硫酸工业废渣(主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%)中提取红氧化铁(Fe2O3)的工艺流程如图(部分操作和条件略):

回答下列问题:
①在步骤i焙烧的目的是
②在步骤iii操作中,滴加氨水除Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5 mol·L-1,则溶液的pH为
③在步骤iv中发生的反应中有一种气态产物,它是
④步骤v中,发生反应的化学方程式为
(3)工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4),可降低生产成本且产品质量优。工艺流程如下:

①由图知需先制得高铁酸钠溶液,然后加入饱和KCl溶液转化为高铁酸钾,说明相同温度下溶解度:高铁酸钾
②写出由铁黄制备高铁酸钠的离子方程式
③高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。放电时电池的正极反应式为
3Zn(OH)2+2Fe(OH)3+4KOH。放电时电池的正极反应式为
您最近一年使用:0次



