贵州省贵阳市2021届高三8月摸底考试化学试题
贵州
高三
开学考试
2020-10-05
595次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础、物质结构与性质
贵州省贵阳市2021届高三8月摸底考试化学试题
贵州
高三
开学考试
2020-10-05
595次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 化学与生产生活密切相关,下列有关叙述正确的是( )
| A.六水合氯化钙可用作食品干燥剂 |
| B.流感疫苗要冷藏存放。以免蛋白质变性 |
| C.利用酒精的强氧化性可以灭活新型冠状病毒 |
| D.N95口罩的原材料聚丙烯是一种天然有机高分子化合物 |
【知识点】 蛋白质的变性 化学科学对人类文明发展的意义解读 合成纤维解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 下列化学用语表达正确的是( )
A.CC14的比例模型: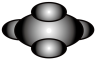 |
| B.核素18O的电子数为10 |
C.次氯酸分子的电子式: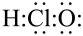 |
D.乙酸与乙醇的酯化反应:CH3CO18OH+C2H5OH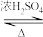 CH3COOC2H5+H218O CH3COOC2H5+H218O |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
3. 下列关于物质分类正确的是( )
| A.烧碱、纯碱、消石灰都属于碱 |
| B.氯化钠、盐酸、乙醇都是电解质 |
| C.空气、淀粉溶液、白酒都是混合物 |
| D.糖类、蛋白质、酚醛树脂都是高分子化合物 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
4. 下列物质有关用途与性质的对应关系正确的是( )
| 选项 | 物质 | 用途 | 性质 |
| A | Si | 制太阳能电池 | 能传导光信号 |
| B | NH3 | 做制冷剂 | NH3具有还原性 |
| C | Al2O3 | 耐高温材料 | Al2O3熔点高 |
| D | NaHCO3 | 焙制糕点 | 能与碱反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 某反应过程的能量变化如图所示,下列说法错误的是( )


| A.该反应为放热反应,∆H>0 |
| B.反应过程b有催化剂参与 |
| C.反应过程a的活化能大于E1 |
| D.该反应可能需要加热才能发生 |
您最近一年使用:0次
单选题
|
适中(0.65)
6. 下列转化在给定条件下不能实现的是( )
A.C CO2 CO2 CO CO | B.S SO2 SO2 SO3 SO3 |
C.NO2 HNO3 HNO3 NO NO | D.Al(OH)3 AlCl3(aq) AlCl3(aq) Al Al |
您最近一年使用:0次
单选题
|
容易(0.94)
7. 室温下。能说明乙酸是弱电解质的是( )
| A.乙酸溶液能导电 |
| B.室温下,0.01mol·L-1乙酸溶液的pH>2 |
| C.乙酸可以与金属钠反应放出氢气 |
| D.乙酸溶液能使紫色石茬试液变红 |
您最近一年使用:0次
8. 下列实验方案中。能达到实验目的的是( )
A.用KMnO4标准溶液进行滴定 |
B.除去Cl2中少量的HCl  |
C.比较HCl、H2CO3和H2SiO3的酸性强弱 |
D.验证2NO2(g) N2O4(g)为放热反应 N2O4(g)为放热反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
9. 某脂环烃的结构如图所示,下列说法正确的是( )
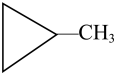

| A.分子式为C4H10 |
| B.其一氯代物共有两种结构 |
| C.可以发生氧化反应、取代反应 |
| D.所有碳原子可能处于同一平面 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
10. 短周期元素R、X、Y、Z在元素周期表中的相对位置如图所示。已知X、Z的原子序数之和是Y的3倍。下列说法正确的是( )
| X | Y | ||
| R | Z |
| A.单质沸点:Z>X>Y |
| B.单质的沸点:Y>X>R |
| C.简单气态氢化物的稳定性:R>Z |
| D.氧化物对应水化物的酸性:Z>X |
【知识点】 元素周期律、元素周期表的推断 “位构性”关系理解及应用解读
您最近一年使用:0次
单选题
|
适中(0.65)
11. 设NA为阿伏加德罗常数的值。下列说法不正确的是( )
| A.0.1mol11B含有的中子数为0.6NA |
| B.16g氧气中含有的氧原子数目为NA |
| C.标准状况下,22.4L乙醇中含有的分子数为NA |
| D.乙烯和丙烯混合气体共28g,所含原子数为6NA |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
12. 下列事实对应的离子方程式正确的是( )
| A.用CuSO4溶液除去H2S气体:Cu2++S2-=CuS↓ |
| B.配制FeSO4溶液时加入适量的铁粉:Fe3++Fe=2Fe2+ |
C.用热的纯碱溶液可以清洗油污:CO +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
| D.用醋酸除水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
13. 在给定条件下,下列各组离子一定能大量共存的是( )
A.澄清透明的溶液中:K+、Fe3+、I-、NO |
B.滴入酚酞显红色的溶液中:Na+、K+、NO 、CO 、CO |
C.c(Ba2+)=0.1mol·L-1的溶液中:NH 、Al3+、SO 、Al3+、SO 、NO 、NO |
D.由水电离出的c(H+)=1×10-14mol·L-1的溶液中:NH 、Na+、Cl-、SO 、Na+、Cl-、SO |
【知识点】 限定条件下的离子共存解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
14. 氢氧燃料电池被人们誉为“绿色电池”,具有广阔的发展前途。如图为电池示意图。已知电池工作时,电流从电极a经由导线流向电极b。则下列说法正确的是( )


| A.该燃料电池能将电能转化为化学能 |
| B.a极的反应为:O2+2H2O+4e-=4OH- |
| C.溶液中的OH-从右室向左室移动 |
| D.电池中电解液的pH逐渐增大 |
您最近一年使用:0次
15. 二氧化氯(ClO2)是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下制备,反应方程式:NaClO3+H2O2+H2SO4→ClO2↑+Na2SO4+H2O+O2↑(未配平)。下列说法不正确的是( )
| A.ClO2是还原产物 |
| B.NaClO3作氧化剂,发生氧化反应 |
| C.NaClO3与H2O2的化学计量系数之比为2:1 |
| D.每生成0.2molClO2反应转移0.2mol电子 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
16. 室温下,向10.00mL0.1000mol·L-1HX中滴加0.1000mol·L-1NaOH溶液。溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是( )


| A.滴定时选用甲基橙作指示剂 |
| B.HX的电离平衡常数的数量级为10-3 |
| C.a点溶液中存在c(Na+)=c(X-) |
| D.滴定至a点时消耗NaOH溶液的体积V1<10mL |
您最近一年使用:0次
2020-10-04更新
|
174次组卷
|
2卷引用:贵州省贵阳市2021届高三8月摸底考试化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
17. 过氧化钙是一种温和的氧化剂,常温下为白色固体,易溶于酸,难溶于水、乙醇等溶剂。
(1)某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙。按气流方向连按顺序为____ (填仪器接口的字母编号,装置可重复使用)。

实验步骤如下:
i.检验装置的气密性后,装入药品;
ii.打开仪器M的活塞,通入一段时间气体,加热药品;
iii.反应结束后。先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;
iv.拆除装置,取出产物。
(2)仪器M的名称为____ ;步骤ⅲ的作用是____ 。
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH 在碱性环境下制取CaO2·8H2O的装置如图:
在碱性环境下制取CaO2·8H2O的装置如图:

①装置A的试管中发生反应的化学方程式为____ 。装置B中的反应需在冰水浴下进行。其原因是____ 。
②将过滤得到的白色晶体依次用蒸馏水、乙醇洗涤,低温烘干可得CaO2·8H2O。用乙醇洗涤的目的是__ ,某同学过滤时的操作示意图如图,操作中不规范之处是____ 。(填标号)。

a.用玻璃棒引流
b.滤纸边缘高出漏斗边缘
c.滤纸湿润后紧贴漏斗壁
d.漏斗末端颈尖未紧靠烧杯壁
(1)某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙。按气流方向连按顺序为

实验步骤如下:
i.检验装置的气密性后,装入药品;
ii.打开仪器M的活塞,通入一段时间气体,加热药品;
iii.反应结束后。先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;
iv.拆除装置,取出产物。
(2)仪器M的名称为
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH
 在碱性环境下制取CaO2·8H2O的装置如图:
在碱性环境下制取CaO2·8H2O的装置如图:
①装置A的试管中发生反应的化学方程式为
②将过滤得到的白色晶体依次用蒸馏水、乙醇洗涤,低温烘干可得CaO2·8H2O。用乙醇洗涤的目的是

a.用玻璃棒引流
b.滤纸边缘高出漏斗边缘
c.滤纸湿润后紧贴漏斗壁
d.漏斗末端颈尖未紧靠烧杯壁
您最近一年使用:0次
18. 铁及其化合物在生产、生活中有重要用途。
(1)常温下,可用铁质容器盛放浓硫酸。原因是___ 。
(2)鉴别FeCl3溶液和Fe(OH)3胶体,除观察颜色外。还能用到的方法是__ 。
(3)Fe2+和Fe3+可以相互转化,若要证明溶液中的Fe2+被氧化生成了Fe3+,可选用的试剂是___ (填化学式)。
(4)保存1.6mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊。应调节溶液的pH不超过__ (已知:常温下,Ksp[Fe(OH)2]=1.6×10-16)
(5)在日常生活和生产中,钢铁的腐蚀普遍存在且危害较大。了解钢铁防离蚀的措施意义重大。利用如图所示装置可以模拟铁的电化学防护。其中Y为NaCl为减缓铁的腐蚀。

①着X为锌、开关K置于M处。这一保护方法叫做___ 。
②若X为碳棒、开关K置于N处,此时铁极为___ (填“阴极”或“阳极”),X极的电极反应式为__ 。
(1)常温下,可用铁质容器盛放浓硫酸。原因是
(2)鉴别FeCl3溶液和Fe(OH)3胶体,除观察颜色外。还能用到的方法是
(3)Fe2+和Fe3+可以相互转化,若要证明溶液中的Fe2+被氧化生成了Fe3+,可选用的试剂是
(4)保存1.6mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊。应调节溶液的pH不超过
(5)在日常生活和生产中,钢铁的腐蚀普遍存在且危害较大。了解钢铁防离蚀的措施意义重大。利用如图所示装置可以模拟铁的电化学防护。其中Y为NaCl为减缓铁的腐蚀。

①着X为锌、开关K置于M处。这一保护方法叫做
②若X为碳棒、开关K置于N处,此时铁极为
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
名校
19. Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料。也可用于镍粉的制造,其一种生产工艺如图。

有关氢氧化物开始沉淀和沉淀完全的pH如表:
(1)Ni2O3中Ni的化合价为___ 。
(2)“酸浸”时温度不宜过高的原因是__ 。
(3)加入H2O2“氧化”的目的是__ 。加入Na2CO3溶液调节溶液pH的范围为__ 。
(4)从滤液A中可回收利用的主要物质是__ 。
(5)加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为__ 。
(6)为测定样品中Ni2O3的质量分数。进行实验;称取5.000g样品。加入足量硫酸后再加入100mL1.0mol·L-1的Fe2+标准溶液。充分反应。加水定容至200mL.取出20.00mL。用0.040mol·L-1KMnO4标准溶液滴定。用去KMnO4标准溶液20.00mL。试通过计算确定Ni2O3的质量分数__ 。测定过程中涉及的反应如下:Ni2O3+2Fe2++6H+=2Ni2++2Fe3++3H2O;5Fe2++MnO +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀时pH | 1.5 | 6.5 | 7.1 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.1 |
(2)“酸浸”时温度不宜过高的原因是
(3)加入H2O2“氧化”的目的是
(4)从滤液A中可回收利用的主要物质是
(5)加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为
(6)为测定样品中Ni2O3的质量分数。进行实验;称取5.000g样品。加入足量硫酸后再加入100mL1.0mol·L-1的Fe2+标准溶液。充分反应。加水定容至200mL.取出20.00mL。用0.040mol·L-1KMnO4标准溶液滴定。用去KMnO4标准溶液20.00mL。试通过计算确定Ni2O3的质量分数
 +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。
您最近一年使用:0次
2020-10-04更新
|
249次组卷
|
2卷引用:贵州省贵阳市2021届高三8月摸底考试化学试题
20. “绿水青山就是金山银山”。合理利用或转化汽车尾气中的NO、NO2等污染性气体是人们共同关注的课题:
(1)臭氧氧化法。烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知NO与O3反应过程的能量变化如图:

则反应3NO(g)+O3(g)=3NO2(g)的∆H=__ kJ·mol-1。
(2)活性炭还原法.有关反应为:C(s)+2NO(g) N2(g)+CO2(g)∆H=+172.5kJ·mol-1,一定温度下,向一个2L密闭容器中加入一定量的活性炭和2mol的NO反应。反应进行到10分钟时达到平衡,此时测得容器中NO和N2的体积比为2:1。则:
N2(g)+CO2(g)∆H=+172.5kJ·mol-1,一定温度下,向一个2L密闭容器中加入一定量的活性炭和2mol的NO反应。反应进行到10分钟时达到平衡,此时测得容器中NO和N2的体积比为2:1。则:
①10分钟内以CO2表示该反应的反应速率为__ mol·L-1min-1。
②下列说法能作为判断该反应达到化学平衡状态标志的是___ 。
a.NO的体积分数保持不变
b.某一时间内生成0.01molN2的同时也生成0.01molCO2
c.容器内气体总物质的量保持不变
d.容器内混合气体的密度保持不变
③此温度下,该反应的平衡常数为__ ,平衡时NO的转化率为__ 。
④20min时。只改变某一条件,反应重新达到平衡。平衡时测得c(NO)=0.4mol·L-1,(N2)=0.3mol·L-1,c(CO2)=0.3mol·L-1。则改变的条件是__ 。
(1)臭氧氧化法。烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知NO与O3反应过程的能量变化如图:

则反应3NO(g)+O3(g)=3NO2(g)的∆H=
(2)活性炭还原法.有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)∆H=+172.5kJ·mol-1,一定温度下,向一个2L密闭容器中加入一定量的活性炭和2mol的NO反应。反应进行到10分钟时达到平衡,此时测得容器中NO和N2的体积比为2:1。则:
N2(g)+CO2(g)∆H=+172.5kJ·mol-1,一定温度下,向一个2L密闭容器中加入一定量的活性炭和2mol的NO反应。反应进行到10分钟时达到平衡,此时测得容器中NO和N2的体积比为2:1。则:①10分钟内以CO2表示该反应的反应速率为
②下列说法能作为判断该反应达到化学平衡状态标志的是
a.NO的体积分数保持不变
b.某一时间内生成0.01molN2的同时也生成0.01molCO2
c.容器内气体总物质的量保持不变
d.容器内混合气体的密度保持不变
③此温度下,该反应的平衡常数为
④20min时。只改变某一条件,反应重新达到平衡。平衡时测得c(NO)=0.4mol·L-1,(N2)=0.3mol·L-1,c(CO2)=0.3mol·L-1。则改变的条件是
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
21. 第四周期的钛、镍、铜、锌等金属元素及其化合物在工业生产和科学研究中具有重要作用。回答下列问题:
(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。基态Zn2+的电子排布式为__ 。葡萄糖酸根[CH2OH(CHOH)4COO-]中手性碳原子(连有四个不同的原子或基团的碳)的个数为___ 。
(2)一些中医典籍中记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。在ZnCO3中,阴离子的空间构型为____ 。
(3)镍元素可形成多种配合物。若配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=___ ;一定条件下,丁二酮肟( )与Ni2+反应生成鲜红色沉淀物的结构如图所示,该沉淀物中所含非金属元素的电负性由小到大的顺序为
)与Ni2+反应生成鲜红色沉淀物的结构如图所示,该沉淀物中所含非金属元素的电负性由小到大的顺序为___ ,碳原子的杂化类型为__ ,该结构中存在的化学键有___ (填字母选项)。

a.离子键 b.共价键 c.金属键 d.配位键
(4)工业上可用TiCl4(常温下呈液态)与Mg高温下反应制备钛单质。同时生成MgCl2,解释TiCl4熔点比MgCl2低很多的原因__ 。
(5)某镍白铜合金的立方晶胞结构如图所示,该晶胞的化学式为__ ,若晶胞参数为anm,则晶胞密度为___ g/cm3。

(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。基态Zn2+的电子排布式为
(2)一些中医典籍中记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。在ZnCO3中,阴离子的空间构型为
(3)镍元素可形成多种配合物。若配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
 )与Ni2+反应生成鲜红色沉淀物的结构如图所示,该沉淀物中所含非金属元素的电负性由小到大的顺序为
)与Ni2+反应生成鲜红色沉淀物的结构如图所示,该沉淀物中所含非金属元素的电负性由小到大的顺序为
a.离子键 b.共价键 c.金属键 d.配位键
(4)工业上可用TiCl4(常温下呈液态)与Mg高温下反应制备钛单质。同时生成MgCl2,解释TiCl4熔点比MgCl2低很多的原因
(5)某镍白铜合金的立方晶胞结构如图所示,该晶胞的化学式为

您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
解题方法
22. 化合物K是合成用于治疗新冠肺炎药物的中间体,由芳香经A进行合成的路线如图。
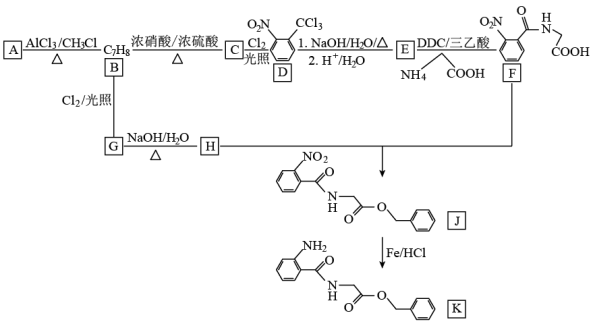
回答下列问题:
(1)已知A的分子式为C6H6,则B的化学名称是___ 。
(2)B→C的反应类型为__ 。D中所含官能团的名称为__ 。
(3)E的结构简式是___ 。
(4)写出G→H的化学方程式___ 。
(5)H与F合成J的反应条件是__ ,该反应过程中会生成分子式为C14H14O的副产物。该副产物的结构简式为__ 。
(6)芳香族化合物M是H的同分异构体。可能的结构有__ 种。共中核磁共振氢谱有四组峰。峰面积之比为3:2:2:1的结构简式为___ 。

回答下列问题:
(1)已知A的分子式为C6H6,则B的化学名称是
(2)B→C的反应类型为
(3)E的结构简式是
(4)写出G→H的化学方程式
(5)H与F合成J的反应条件是
(6)芳香族化合物M是H的同分异构体。可能的结构有
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础、物质结构与性质
试卷题型(共 22题)
题型
数量
单选题
16
解答题
6
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 蛋白质的变性 化学科学对人类文明发展的意义 合成纤维 | |
| 2 | 0.65 | 化学用语综合判断 有机物的结构式、结构简式、比例模型、球棍模型、最简式 乙酸的酯化反应的机理 | |
| 3 | 0.85 | 化学物质的分类方法 分类方法的应用 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系 | |
| 4 | 0.85 | 氨气的结构与性质 硅单质 硅的物理性质与用途 氧化铝的物理性质与用途 | |
| 5 | 0.65 | 化学反应中能量变化的原因 化学键与化学反应中的能量关系 活化能及其对反应速率的影响 催化剂对化学反应速率的影响 | |
| 6 | 0.65 | 硝酸的强氧化性 含硫化合物之间的转化 铝三角转化 | |
| 7 | 0.94 | 强电解质和弱电解质的判断 强电解质与弱电解质 弱电解质在水溶液中的电离平衡 | |
| 8 | 0.65 | 氯气的实验室制法 二氧化氮与四氧化二氮的相互转化 酸碱中和滴定实验相关仪器 实验方案设计的基本要求 | |
| 9 | 0.65 | 有机化合物中碳的成键特征 同分异构体的数目的确定 有机分子中原子共面的判断 | |
| 10 | 0.65 | 元素周期律、元素周期表的推断 “位构性”关系理解及应用 | |
| 11 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 乙醇的组成、结构 | |
| 12 | 0.85 | 离子反应的发生及书写 离子方程式的正误判断 | |
| 13 | 0.85 | 限定条件下的离子共存 | |
| 14 | 0.65 | 原电池原理 氢氧燃料电池 | |
| 15 | 0.65 | 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应在生活、生产中的应用 氧化还原反应的规律 | |
| 16 | 0.65 | 酸碱中和滴定指示剂选择 弱电解质的电离平衡 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 17 | 0.65 | 物质含量的测定 物质制备的探究 | 实验探究题 |
| 18 | 0.65 | 铁与强氧化性酸的反应 铁盐的检验 沉淀的溶解与生成 金属的防护 | 原理综合题 |
| 19 | 0.65 | 有关铁及其化合物转化的流程题型 物质分离、提纯综合应用 | 工业流程题 |
| 20 | 0.4 | 盖斯定律及其有关计算 化学反应速率计算 化学平衡的有关计算 化学平衡状态的判断方法 | 原理综合题 |
| 21 | 0.65 | 电负性 价层电子对互斥理论 配合物的结构与性质 晶胞的有关计算 | 结构与性质 |
| 22 | 0.4 | 根据要求书写同分异构体 同分异构体的数目的确定 多官能团有机物的结构与性质 有机推断综合考查 | 有机推断题 |



