恒温下,容器中发生反应N2(g)+3H2(g)⇌2NH3(g),增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
| A.改变反应的路径,使反应所需的活化能降低 |
| B.反应物分子的能量增加,活化分子百分数增大;有效碰撞次数增多 |
| C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多 |
| D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
20-21高二上·广东广州·阶段练习 查看更多[2]
广东省广州市第一一三中学22020-2021学年高二上学期第一阶段考试化学(选考)试题(已下线)2.1.3 活化能(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
更新时间:2020-10-26 16:50:52
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列说法正确的是
| A.温度越高,所有催化剂的催化效果越好 |
| B.NH3(g)和HCl(g)反应生成NH4Cl(s),其ΔS<0 |
| C.改变温度一定加快化学反应速率 |
| D.增大反应物浓度,使活化分子百分数增加,化学反应速率增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列说法错误的是( )
| A.发生有效碰撞的分子一定是活化分子 |
| B.活化分子间的碰撞一定是有效碰撞 |
| C.只有发生有效碰撞才能发生化学反应 |
| D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】能改变反应物分子中活化分子百分数的条件是
①浓度 ②压强 ③温度 ④催化剂
①浓度 ②压强 ③温度 ④催化剂
| A.①③ | B.②④ | C.③④ | D.①②③④ |
您最近一年使用:0次
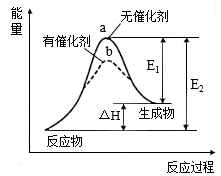
【推荐2】SO2(g)+O2(g)→SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述正确的是


| A.该反应的逆反应为吸热反应,SO2的能量一定高于SO3的能量 |
| B.该反应中,反应物的总键能小于生成物的总键能 |
| C.ΔH=E2-E1,使用催化剂改变活化能,但不改变反应热 |
D.500℃、101kPa下,将1mol SO2(g)和0.5mol O2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) 2SO3(g) ΔH=-2akJ·mol-1 2SO3(g) ΔH=-2akJ·mol-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】煅烧硫铁矿产生二氧化硫,为了提高生成二氧化硫的速率,下列措施可行的是
| A.把块状矿石碾成粉末 | B.减小体系压强 | C.减小O2的浓度 | D.降低体系的温度 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】反应 在密闭容器中进行,下列条件的改变能加快反应速率的是
在密闭容器中进行,下列条件的改变能加快反应速率的是
①升温 ②增加C的量 ③将容器的体积缩小一半 ④保持体积不变,充入He使体系压强增大
⑤保持压强不变,充入He ⑥保持体积不变,充入水蒸气使体系压强增大
 在密闭容器中进行,下列条件的改变能加快反应速率的是
在密闭容器中进行,下列条件的改变能加快反应速率的是①升温 ②增加C的量 ③将容器的体积缩小一半 ④保持体积不变,充入He使体系压强增大
⑤保持压强不变,充入He ⑥保持体积不变,充入水蒸气使体系压强增大
| A.①③④⑥ | B.②③⑥ | C.①③⑥ | D.①②④ |
您最近一年使用:0次

 2Z(g);
2Z(g);