有甲、乙两个研究性学习小组分别设计了以下实验
I.甲组同学,为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图A、B所示的实验。请回答下列问题:
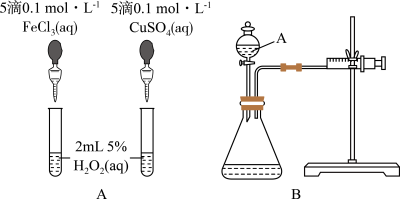
(1)定性比较:图A可通过观察__ ,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理,其理由是___ 。
(2)定量比较:如图B所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是__ ,实验中需要测量的数据是__ 。
(3)将0.1mol MnO2粉末加入到50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。计算H2O2的初始物质的量浓度__ 。(请保留两位有效数字)
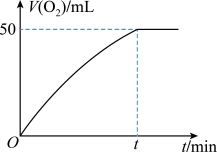
Ⅱ.乙组同学按照如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。

(1)实验原理:硫代硫酸钠溶液与稀硫酸反应。
(2)实验目的:
装置A,探究浓度对化学反应速率的影响;装置B,探究__ 对化学反应速率的影响。
(3)通过A、B装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
结论:由___ 和___ (填Ⅰ或Ⅱ或Ⅲ)两组数据可知,其他条件一定时,反应物的浓度越大,化学反应速率越快。
I.甲组同学,为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图A、B所示的实验。请回答下列问题:

(1)定性比较:图A可通过观察
(2)定量比较:如图B所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是
(3)将0.1mol MnO2粉末加入到50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。计算H2O2的初始物质的量浓度

Ⅱ.乙组同学按照如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。

(1)实验原理:硫代硫酸钠溶液与稀硫酸反应。
(2)实验目的:
装置A,探究浓度对化学反应速率的影响;装置B,探究
(3)通过A、B装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验组号 | 温度/℃ | Na2S2O3溶液 | H2SO4 | 加入H2O的体积/mL | 出现沉淀所需时间/s | ||
| 体积 /mL | 浓度(mol•L−1) | 体积/mL | 浓度/(mol•L−1) | ||||
| I | 0 | 5 | 0.1 | 10 | 0.1 | 5 | 8 |
| Ⅱ | 0 | 5 | 0.1 | 5 | 0.1 | 10 | 12 |
| Ⅲ | 30 | 5 | 0.1 | 5 | 0.1 | 10 | 4 |
更新时间:2020-11-02 17:17:02
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某小组同学研究影响双氧水分解反应速率的因素。实验所用试剂:10%H2O2、蒸馏水、MnO2粉末
(1)实验1、2的目的是研究________ 对双氧水分解反应速率的影响。
(2)通过对比实验_______ (填序号),可研究催化剂对双氧水分解反应速率的影响。
(3)为了准确地比较反应速率的快慢,观测的方法是:收集相同体积的气体,__________ 。
(4)利用上述实验试剂,并结合已有实验方案,进一步设计实验研究双氧水浓度对其分解反应速率的影响。请将实验方案补全。
| 实验序号 | H2O2浓度 | V(H2O2溶液) | 温度 | 催化剂 | 实验现象 |
1 | 10% | 20mL | 室温 | 无 | 无明显现象 |
2 | 10% | 20mL | 50℃水浴 | 无 | 有较多气泡产生 |
3 | 10% | 20mL | 室温 | MnO2(0.2g) | 有较多气泡产生 |
(1)实验1、2的目的是研究
(2)通过对比实验
(3)为了准确地比较反应速率的快慢,观测的方法是:收集相同体积的气体,
(4)利用上述实验试剂,并结合已有实验方案,进一步设计实验研究双氧水浓度对其分解反应速率的影响。请将实验方案补全。
| 实验序号 | H2O2浓度 | 实验现象 | ||||
4 | 10% | ① | ② | ③ | ④ | ⑤ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)写出草酸与高锰酸钾反应的离子方程式____________________________________ 。
(2)通过实验A、B,可探究出________ (填外部因素)的改变对化学反应速率的影响,其中V1=________ 、T1=________ ;通过实验________ (填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________ 。
(3)若t1<8,则由此实验可以得出的结论是______________________________________ ;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)________ 。
Ⅱ催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图所示的实验,用控制变量法比较Fe3+和Cu2+对H2O2分解的催化效果。请回答相关问题:
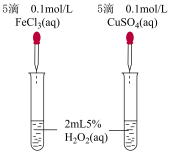
(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论_____ 填 (“合理”或“不合理”),原因________________ 。
(5)向50ml H2O2溶液中加入0.10molMnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示。
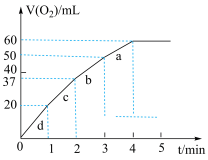
①实验中放出气体的总体积是__________ mL。
②H2O2的初始物质的量浓度是____________ (保留2位有效数字)。
③a、d两段反应速率大小的顺序为_____ >_____ ,原因_____________________________ 。
| 实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol﹒L-1 | V mL | c/mol﹒L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(2)通过实验A、B,可探究出
(3)若t1<8,则由此实验可以得出的结论是
Ⅱ催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图所示的实验,用控制变量法比较Fe3+和Cu2+对H2O2分解的催化效果。请回答相关问题:

(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论
(5)向50ml H2O2溶液中加入0.10molMnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示。

①实验中放出气体的总体积是
②H2O2的初始物质的量浓度是
③a、d两段反应速率大小的顺序为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.某校化学实验小组探究浓度对化学反应速率的影响,并测定 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
 和KI反应的离子方程式为:
和KI反应的离子方程式为:
 (1)
(1)
平均反应速率的计算式为 。
。
实验时,向 、
、 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应:
 (2)
(2)
反应(1)生成的 立即与
立即与 反应,生成无色的
反应,生成无色的 和
和 。
。 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是_____ 。
(3)第①组实验的
________ mol·(L·s) 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)_____ 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:


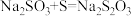
该小组根据上述原理设计如图19所示装置制备 。
。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是①____ ;②____ 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是________ 。
(3)反应结束后,从制得的 稀溶液中得到
稀溶液中得到 晶体的主要操作包括:
晶体的主要操作包括:__________ 。
 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:【实验原理】
 和KI反应的离子方程式为:
和KI反应的离子方程式为: (1)
(1)平均反应速率的计算式为
 。
。实验时,向
 、
、 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入 溶液,不断搅拌。
溶液,不断搅拌。在反应(1)进行的同时,发生反应:
 (2)
(2)反应(1)生成的
 立即与
立即与 反应,生成无色的
反应,生成无色的 和
和 。
。 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为 。
。【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 | ① | ② | ③ | ④ | ⑤ | |
| 试剂 用量 (mL) | 0.20 mol·L (NH4)2S2O8溶液 (NH4)2S2O8溶液 | 20.0 | 10.0 | 20.0 | 20.0 | |
0.20 mol·L KI溶液 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
0.010 mol·L Na2S2O3溶液 Na2S2O3溶液 | 8.0 | 8.0 | 8.0 | 8.0 | ||
| 0.2%淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
0.20 mol·L KNO3溶液 KNO3溶液 | 0 | 0 | 0 | 10.0 | ||
0.20 mol·L (NH4)2SO4溶液 (NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
20℃时,反应时间 | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是
(3)第①组实验的

 。
。(4)根据上表数据分析,可以得到的结论有(写出一条即可)
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:


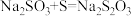
该小组根据上述原理设计如图19所示装置制备
 。
。
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是①
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是
(3)反应结束后,从制得的
 稀溶液中得到
稀溶液中得到 晶体的主要操作包括:
晶体的主要操作包括:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.(1)25℃、101kPa时,使1.0 g乙烯与足量的氧气反应,生成CO2和液态H2O并放出50 KJ的热量,表示乙烯燃烧热的热化学方程式为_________________________ 。
(2)比较下列热化学方程式中ΔH的大小关系。
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (l) ΔH1
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (g) ΔH2
则ΔH1________ ΔH2
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C (s,石墨) + O2 (g) = CO2 (g) ΔH1
2H2 (g) + O2 (g ) = 2H2O (l) ΔH2
2C2H2 (g) + 5 O2 (g ) = 4 CO2 (g) +2 H2O (1) ΔH3
则2C (s,石墨)+ H2 (g)= C2H2 (g) 反应的ΔH的表达式为:ΔH =_____ 。
II. 草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4- + 5H2C2O4 + 6H+ = 2 Mn2++ 10CO2↑ + 8H2O。现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
(4)如果研究催化剂对化学反应速率的影响,使用实验_______ 和____ (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验_____ 和______ 。
(5)对比实验I和IV,可以研究_________________ 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 _______________________ 。
(2)比较下列热化学方程式中ΔH的大小关系。
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (l) ΔH1
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (g) ΔH2
则ΔH1
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C (s,石墨) + O2 (g) = CO2 (g) ΔH1
2H2 (g) + O2 (g ) = 2H2O (l) ΔH2
2C2H2 (g) + 5 O2 (g ) = 4 CO2 (g) +2 H2O (1) ΔH3
则2C (s,石墨)+ H2 (g)= C2H2 (g) 反应的ΔH的表达式为:ΔH =
II. 草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4- + 5H2C2O4 + 6H+ = 2 Mn2++ 10CO2↑ + 8H2O。现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | / |
| II | 2 mL | 20 | MnSO4固体 |
| III | 2 mL | 30 | / |
| IV | 1 mL | 20 | 1 mL蒸馏水 |
(5)对比实验I和IV,可以研究
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】关于煤的处理是工业重要的生产工艺,从煤的气化到液化是重要环节。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:
Ⅰ.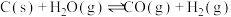

Ⅱ.
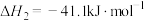
①下列说法正确的是_______ 。
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系_______ (填“吸收”或“放出”)热量_______ kJ,反应Ⅰ的平衡常数
_______ MPa(以分压表示,分压=总压×物质的量分数)。
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为
 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
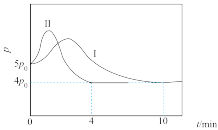
①曲线Ⅱ所对应的改变的条件可能为_______ 。
②体系总压强先增大的原因为_______ ,后减小的原因为_______ 。
③该条件下 的平衡转化率为
的平衡转化率为_______ %(结果保留三位有效数字)。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和
 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:Ⅰ.
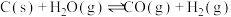

Ⅱ.

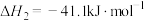
①下列说法正确的是
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率②反应平衡时,
 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为

 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
①曲线Ⅱ所对应的改变的条件可能为
②体系总压强先增大的原因为
③该条件下
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知 为阿伏加 德罗常数的值):
为阿伏加 德罗常数的值):
(1)请写出该反应的离子方程式:___ ,当该反应以实验①中数据反应完全时转移电子数为_____  。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______ ,V2=__________ 。
(3)根据实验①、②的数据,可以得到的结论是____ 。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
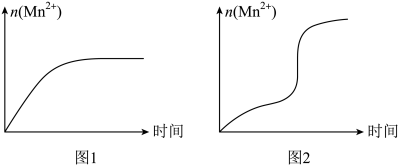
该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
①该小组同学提出的新假设是__________ 。
②若该小组同学提出的假设成立,应观察到__________ (填实验现象)。
 为阿伏加 德罗常数的值):
为阿伏加 德罗常数的值):| 试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
| 实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
| ① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
 。
。(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=
(3)根据实验①、②的数据,可以得到的结论是
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
| 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
| ④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
②若该小组同学提出的假设成立,应观察到
您最近一年使用:0次



