燃料电池是利用燃料(如H2、CO、CH4、CH3OH、NH3等)与O2反应从而将化学能转化为电能的装置。
(1)甲烷燃料电池(NaOH作电解质溶液)的负极反应式为_______________________ ,放电过程中溶液的碱性____________ (填“增强”“减弱”或“不变”)。
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下图,有关说法正确的是(填字母)( )
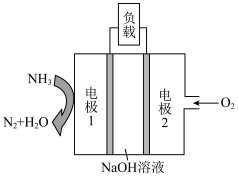
a.电池工作时,Na+向负极移动
b.电子由电极2经外电路流向电极1
c.电池总反应为4NH3+3O2=2N2+6H2O
d.电极2发生的电极反应为O2+4H++4e-=2H2O
(3)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
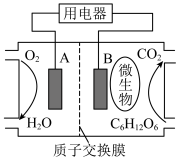
①B为生物燃料电池的______ 极,其电极反应式为;_________________
②在电池反应中每消耗1 mol氧气,理论上生成标准状况下CO2_____ L。
③该电池________ (填“能”或“不能”)在高温下工作。
(1)甲烷燃料电池(NaOH作电解质溶液)的负极反应式为
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下图,有关说法正确的是(填字母)

a.电池工作时,Na+向负极移动
b.电子由电极2经外电路流向电极1
c.电池总反应为4NH3+3O2=2N2+6H2O
d.电极2发生的电极反应为O2+4H++4e-=2H2O
(3)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①B为生物燃料电池的
②在电池反应中每消耗1 mol氧气,理论上生成标准状况下CO2
③该电池
更新时间:2020-11-10 10:27:12
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】观察图A、B,回答下列问题:
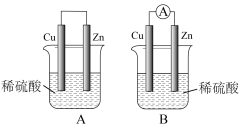
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡产生,再平行插入一块铜片,可观察到铜片_______ (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为______ 。
(2)如果烧杯中最初装入的是2mol·L-1500mL的稀硫酸,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线流入铜电极),当在标准状况下收集到11.2L的氢气时,烧杯内溶液中溶质的物质的量浓度分别为(请指明溶质,溶液体积变化忽略不计)______ 、________ 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=== +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是______ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子

(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡产生,再平行插入一块铜片,可观察到铜片
(2)如果烧杯中最初装入的是2mol·L-1500mL的稀硫酸,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线流入铜电极),当在标准状况下收集到11.2L的氢气时,烧杯内溶液中溶质的物质的量浓度分别为(请指明溶质,溶液体积变化忽略不计)
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-===
 +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】氢能源是最具前景的应用能源之一,氢气的制备和应用是目前的研究热点。回答下列问题:
氨气中氢含量高,可通过氨热分解法制氢气。一定温度下,利用催化剂将NH3分解为N2和H2,反应过程中的能量变化如图所示。
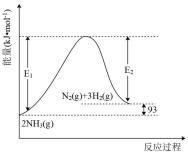
(1)已知断开(或形成)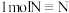 键、
键、 键分别需要吸收(或放出)
键分别需要吸收(或放出)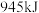 、
、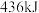 的热量,则断开
的热量,则断开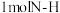 吸收的热量为
吸收的热量为___________ kJ,利用该反应制备标况下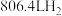 时,吸收的热量为
时,吸收的热量为___________ kJ。
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
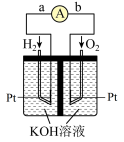
①氢氧燃料电池能量转化的主要形式是___________ ,在导线中电子流动方向为___________ (用a、b表示)。
②负极反应式为___________ 。
(3)电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一、金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2=2LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是___________ ,反应Ⅱ中的氧化剂是___________ 。
②金属锂吸收的氢气与放出的氢气的物质的量之比为___________ 。
氨气中氢含量高,可通过氨热分解法制氢气。一定温度下,利用催化剂将NH3分解为N2和H2,反应过程中的能量变化如图所示。

(1)已知断开(或形成)
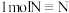 键、
键、 键分别需要吸收(或放出)
键分别需要吸收(或放出)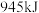 、
、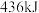 的热量,则断开
的热量,则断开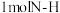 吸收的热量为
吸收的热量为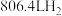 时,吸收的热量为
时,吸收的热量为(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

①氢氧燃料电池能量转化的主要形式是
②负极反应式为
(3)电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一、金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2=2LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是
②金属锂吸收的氢气与放出的氢气的物质的量之比为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】回答下列问题:
(1)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图:
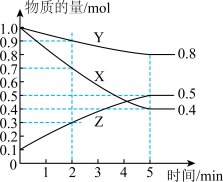
①该反应的化学方程式是_______ 。
②2min内X的转化率为_______ 。
(2)KMnO4是实验室中常用的一种试剂。回答下列问题:
①在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+1OCO2↑+ 8H2O,若将该反应设计成原电池,则正极反应式为_______ 。
②在10mL 0.1 mol/L KMnO4溶液(含稀硫酸)中加入15 mL0.5 mol/L草酸溶液,收集到的CO2的量与时间的关系如图所示。AB段反应速率增大的原因可能是_______ (填字母)。
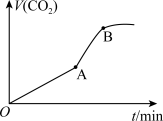
A.该反应是放热反应 B.反应物浓度增大
C.K2SO4起催化作用 D.MnSO4起催化作用
(1)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图:

①该反应的化学方程式是
②2min内X的转化率为
(2)KMnO4是实验室中常用的一种试剂。回答下列问题:
①在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+1OCO2↑+ 8H2O,若将该反应设计成原电池,则正极反应式为
②在10mL 0.1 mol/L KMnO4溶液(含稀硫酸)中加入15 mL0.5 mol/L草酸溶液,收集到的CO2的量与时间的关系如图所示。AB段反应速率增大的原因可能是

A.该反应是放热反应 B.反应物浓度增大
C.K2SO4起催化作用 D.MnSO4起催化作用
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】原电池和电解池都能实现能量的转换。回答下列问题:
(1)银锌电池广泛用作各种电子仪器的电源,它的充电、放电过程可表示为2Ag+Zn(OH)2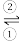 Ag2O+Zn+H2O,电池的放电过程是
Ag2O+Zn+H2O,电池的放电过程是___________ (填“①”或“②”),Ag2O电极发生的反应是___________ (填“氧化反应”或“还原反应”)。
(2)科学家预言,燃料电池将是21世纪获得电力的重要途径,在稀硫酸电解质中直接加入纯化后的甲醇 ,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为
,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为___________ 。
(3) Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___________ ,欲除去Cu2+,最好选用下列试剂中的___________ (填字母)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(1)银锌电池广泛用作各种电子仪器的电源,它的充电、放电过程可表示为2Ag+Zn(OH)2
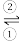 Ag2O+Zn+H2O,电池的放电过程是
Ag2O+Zn+H2O,电池的放电过程是(2)科学家预言,燃料电池将是21世纪获得电力的重要途径,在稀硫酸电解质中直接加入纯化后的甲醇
 ,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为
,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为(3) Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
A.NaOH B.Zn C.Fe D.NH3·H2O
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】以甲醇(CH3OH)为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

(1)甲醇所含官能团的名称为____ 。
(2)该燃料电池正极为___ (填“A”或“B”),B极上的电极反应式为____ 。
(3)目前已开发出氯碱工业的新工艺如图所示,电解前左右两个反应室中溶液均为100mL,(电解过程中溶液体积变化忽略不计,右侧少量NaOH含量极少,忽略不计)。
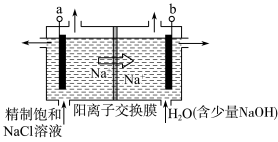
①如图用石墨作电极,在一定条件下电解饱和食盐水。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的___ (填“A”或“B”)极,写出阳极的电极反应式:__ ;写出电解饱和食盐水的化学方程式___ 。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。阳离子交换膜左边反应室中减少的离子的物质的量为___ mol。

(1)甲醇所含官能团的名称为
(2)该燃料电池正极为
(3)目前已开发出氯碱工业的新工艺如图所示,电解前左右两个反应室中溶液均为100mL,(电解过程中溶液体积变化忽略不计,右侧少量NaOH含量极少,忽略不计)。

①如图用石墨作电极,在一定条件下电解饱和食盐水。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。阳离子交换膜左边反应室中减少的离子的物质的量为
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】用CH4和O2组合形成的质子交换膜燃料电池的结构如图丙:
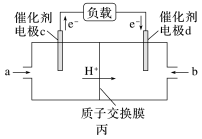
(1)电极c为电子_______ (填流入或流出)的一极,H+移向_______ (填正极或负极)。
(2)气体a为_______ (CH4或O2),若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为_______ L。

(1)电极c为电子
(2)气体a为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__ 极(填“正”或“负”),负极的电极反应式为__ ,正极的电极反应式为___ 。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
①如图为某实验小组依据的氧化还原反应:__ (用离子方程式表示)设计的原电池装置。
②其他条件不变,若将CuCl2溶液换为HCl溶液,石墨的电极反应式为___ 。
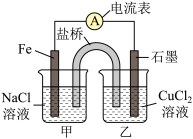
(3)如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。试回答下列问题:

①A极材料是___ ,电极反应为___ ,B极材料是__ ,主要电极反应为__ ,电解质溶液为___ 。
②乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈___ 色。
③常温下,若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为___ ,若此时乙池剩余液体为400mL,则电解后溶液pH为___ 。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
①如图为某实验小组依据的氧化还原反应:
②其他条件不变,若将CuCl2溶液换为HCl溶液,石墨的电极反应式为

(3)如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。试回答下列问题:

①A极材料是
②乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈
③常温下,若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】电絮凝技术(EC)是一种集混凝、气浮、电化学于一体的新兴水处理技术,实验表明电絮凝技术能除去废水中96%以上的磷(主要以PO 形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
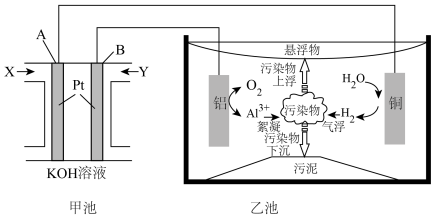
回答下列问题:
(1)燃料电池中OH-向___________ 极(填A或B)移动。写出A电极反应式___________ 。
(2)乙池中铜电极发生___________ 反应(填“氧化”或“还原”)。
(3)乙池铝电极上存在两个竞争反应,电极反应式分别为___________ ,___________ 。
(4)乙池由于电解过程中产生能吸附水中油污等污染物。用离子方程式说明净水的原因为___________ 。
 形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
回答下列问题:
(1)燃料电池中OH-向
(2)乙池中铜电极发生
(3)乙池铝电极上存在两个竞争反应,电极反应式分别为
(4)乙池由于电解过程中产生能吸附水中油污等污染物。用离子方程式说明净水的原因为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】CO、NOx、SO2都是大气污染物,可利用化学反应原理给予消除。
(1)在一定条件下利用反应2CO(g)+SO2(g)=2CO2(g)+S(s)消除CO、SO2,并获得硫黄。已知常温常压下,硫黄的燃烧热△H=-296kJ·mol-1,CO的燃烧热△H=-283kJ·mol-1,则2CO(g)+SO2(g)=2CO2(g)+S(s) △H=____ 。
(2)利用CO还原NO的反应可消除汽车尾气引起的污染并获得电能,其简易装置如图所示(Na+交换膜两侧为等体积等浓度的NaOH溶液):
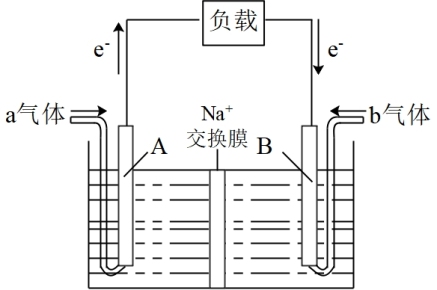
①电极A的电极反应式为____ 。
②工作一段时间后,若B极区与A极区相差0.02molNa+时,外电路中转移电子的物质的量是____ mol。
(3)利用如图所示的电化学装置可消除雾霾中的NO、SO2。

①该装置中电子的流向是____ (填“A→C”或“C→A”)。
②电极B的电极反应式为____ 。
(1)在一定条件下利用反应2CO(g)+SO2(g)=2CO2(g)+S(s)消除CO、SO2,并获得硫黄。已知常温常压下,硫黄的燃烧热△H=-296kJ·mol-1,CO的燃烧热△H=-283kJ·mol-1,则2CO(g)+SO2(g)=2CO2(g)+S(s) △H=
(2)利用CO还原NO的反应可消除汽车尾气引起的污染并获得电能,其简易装置如图所示(Na+交换膜两侧为等体积等浓度的NaOH溶液):

①电极A的电极反应式为
②工作一段时间后,若B极区与A极区相差0.02molNa+时,外电路中转移电子的物质的量是
(3)利用如图所示的电化学装置可消除雾霾中的NO、SO2。

①该装置中电子的流向是
②电极B的电极反应式为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。

(1)正极材料为___________ 。
(2)写出另一电极的电极反应式__________ 。
(3)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?________ (增大、减小、不变)。
(4)当电池工作时通过电路对外提供了1mol电子,计算消耗的负极的质量_______ 。
(5)利用下列反应:Fe+2Fe3+=3Fe2+设计一个原电池,请选择适当的材料和试剂。
①电解质溶液为_____________ 。
②负极反应式:____________________ 。
③溶液中Fe3+向__________ 极移动。

(1)正极材料为
(2)写出另一电极的电极反应式
(3)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?
(4)当电池工作时通过电路对外提供了1mol电子,计算消耗的负极的质量
(5)利用下列反应:Fe+2Fe3+=3Fe2+设计一个原电池,请选择适当的材料和试剂。
①电解质溶液为
②负极反应式:
③溶液中Fe3+向
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】十九大报告提出要对环境问题进行全面、系统的可持续治理。回答下列问题:
Ⅰ.浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的装置如下图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。
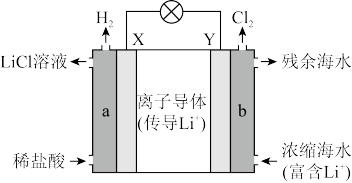
(1)X极为_______ 极,Y极电极反应式:_______ 。
(2)Y极生成1mol 时,
时,_______ mol 移向
移向_______ (填“X”或“Y”)极。
Ⅱ.汽车普遍使用的铅酸蓄电池放电时总反应式为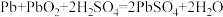 。
。
(3)当外电路通过1 mol电子时,理论上负极板的质量比正极板的质量多增加_______ g,电池中消耗的硫酸物质的量为_______ mol。
Ⅲ.标准状况下,1.68L某气态烃在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到白色沉淀质量为15g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(4)燃烧产物中水的质量为_______ g。
(5)若原气体是单一气体,则其电子式为_______ ,若将该气体设计成碱性(KOH)燃料电池,请写出负极电极反应式_______ 。
Ⅰ.浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的装置如下图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

(1)X极为
(2)Y极生成1mol
 时,
时, 移向
移向Ⅱ.汽车普遍使用的铅酸蓄电池放电时总反应式为
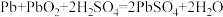 。
。(3)当外电路通过1 mol电子时,理论上负极板的质量比正极板的质量多增加
Ⅲ.标准状况下,1.68L某气态烃在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到白色沉淀质量为15g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(4)燃烧产物中水的质量为
(5)若原气体是单一气体,则其电子式为
您最近半年使用:0次

 -空气电池如图所示,其中在
-空气电池如图所示,其中在 电极发生反应
电极发生反应 ,负载通过
,负载通过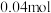 电子时,有
电子时,有 (标准状况)
(标准状况) 参与反应。正极区溶液的
参与反应。正极区溶液的



