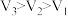已知碘酸( HIO3)为弱酸,以下事实不能说明碘酸是弱酸的是
| A.常温下,1 L浓度为0.1 mol· L-1的HIO3溶液的pH > 1 |
| B.等体积、等物质的量浓度的碘酸溶液和盐酸,与同浓度、同体积的小苏打溶液反应,开始时加入盐酸的溶液中放出气体的速率快,加入碘酸溶液的较慢 |
| C.用HIO3溶液进行导电性实验,灯泡很暗 |
| D.取等体积、等pH的盐酸和碘酸溶液,分别用一定浓度的NaOH溶液进行滴定,恰好反应完全时,后者消耗碱液的体积较大 |
19-20高三·浙江·阶段练习 查看更多[3]
更新时间:2020-11-11 22:17:01
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 的
的 ,
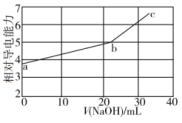
,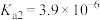 )溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列说法正确的是
)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列说法正确的是
 的
的 ,
,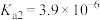 )溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列说法正确的是
)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列说法正确的是
A. 与 与 的导电能力之和比 的导电能力之和比 的大 的大 |
B.a、b、c三点对应的溶液中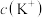 相等 相等 |
C.a点对应的溶液中: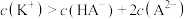 |
D.b点的混合溶液中,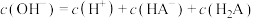 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】下列电离方程式书写正确的是
A.H2CO3 2H++CO 2H++CO | B.HClO H++ClO— H++ClO— |
| C.HCOOH=HCOO-+H+ | D.Ca(OH)2 Ca2++2OH— Ca2++2OH— |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列实验事实不能证明HNO2是弱电解质的是
| A.相同体积,相同浓度的盐酸和HNO2溶液分别与等浓度的NaOH溶液恰好中和后,消耗NaOH溶液的体积 |
| B.常温下,测得0.1 mol·L-1HNO2溶液的pH=3 |
| C.常温下,将pH=2的HNO2溶液稀释1 000倍,测得pH<5 |
| D.用PH计测量等浓度的NaCl 溶液和 NaNO2溶液的pH |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】常温下,下列事实不能说明某一元酸HX是弱酸的是
| A.0.1 mol·L-1 HX溶液的pH=4 |
| B.0.1 mol·L-1 NaX溶液pH>7 |
| C.0.1 mol·L-1HX溶液比0.1 mol·L-1硝酸导电能力弱 |
| D.10mL 0.1 mol·L-1 NaOH溶液与10 mL 0.1 mol·L-1 HX溶液恰好中和 |
您最近一年使用:0次


 +H2O=CO
+H2O=CO +H3O+
+H3O+
 、HCl、
、HCl、 的三种酸溶液,滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体职分别为
的三种酸溶液,滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体职分别为 、
、 、
、 ,则三者的大小关系正确的是
,则三者的大小关系正确的是