下列说法中错误的是( )


A.从CH4、NH 、SO 、SO 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、PO 、PO 也为正四面体结构 也为正四面体结构 |
| B.12g金刚石晶体中,平均含有2NAC—C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
20-21高二·四川乐山·期中 查看更多[3]
(已下线)3.2 分子晶体与共价晶体(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)山东省滨州市博兴县、阳信县2020-2021学年高二下学期联合期中考试化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题
更新时间:2020-11-22 16:35:40
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有
| A.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化 |
| B.NH3的空间构型为平面三角形 |
| C.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2 |
| D.Ni2+在形成配合物时,其配位数只能为4 |
您最近半年使用:0次
【推荐2】三氯化氮(NCl3)是一种淡黄色的油状液体,测得其分子具有三角锥形结构。则下面对于NCl3的描述不正确的是( )
| A.它是一种极性分子 |
| B.它的挥发性比PBr3要大 |
| C.它还能再以配位键与Cl-结合 |
| D.已知NBr3对光敏感,所以NCl3对光也敏感 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列有关说法正确的是

A. 属于元素周期表中的 属于元素周期表中的 区元素 区元素 |
| B.硒、硅分别与氢元素形成的简单氢化物的分子构型均为正四面体形 |
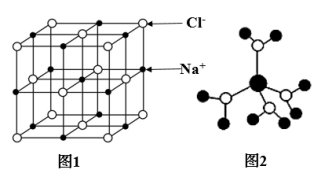
C.在 晶体(图1)中,与 晶体(图1)中,与 最接近且距离相等的 最接近且距离相等的 形成正四面体 形成正四面体 |
| D.某水合金属离子的模型如图2所示,则1个该水合金属离子中含有4个配位键 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】将乙烯通入过氧化氢溶液,能获得乙二醇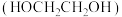 。下列说法正确的是
。下列说法正确的是
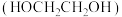 。下列说法正确的是
。下列说法正确的是A.羟基的电子式: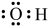 |
B.乙烯分子中π键的形成: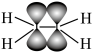 |
C. 中O原子的 中O原子的 模型: 模型: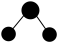 |
D.乙烯分子中碳原子价层电子轨道表示式: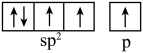 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列图像正确的是
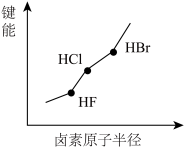 |  | 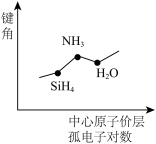 | 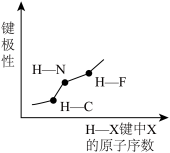 |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐2】下列叙述正确的是
| A.液晶是由分子较大、分子形状呈长形或碟形的物质形成的晶体 |
| B.制造光导纤维的主要材料是高纯度硅,属于原子晶体 |
| C.H2O分子比H2S分子稳定是因为水分子之间存在氢键 |
| D.NaCl和MgO晶体熔融时克服的作用力相同 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列有关表述正确的是( )
| A.S2-的电子排布式:1s22s22p63s23p4 | B.硫原子的价电子排布式:3s23p4 |
| C.氮化硅的分子式:Si4N3 | D.N 原子的电子排布图为: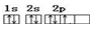 |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐2】下列关于共价晶体、分子晶体的叙述中,正确的是
| A.金刚石为共价键三维骨架结构,晶体中的最小环上有6个碳原子 |
| B.分子晶体中一定存在共价键 |
| C.HI的相对分子质量大于HF,所以HI的沸点高于HF |
| D.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 |
您最近半年使用:0次

 、
、 的说法正确的是
的说法正确的是


