某小组拟探究双氧水和铁离子的氧化性强弱,设计如下实验装置。
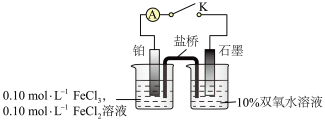
注明:盐桥为饱和KCl溶液和琼脂,烧杯中溶液均为100mL.
(1)用30%双氧水配制10%的双氧水需要使用的玻璃仪器有__________________ (填名称)。已知:30%双氧水的密度约为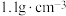 ,该双氧水溶液的物质的量浓度约为
,该双氧水溶液的物质的量浓度约为________ (保留1位小数)。
(2)关闭K,电流计显示电子由石墨极流出经外电路流入铂极。盐桥中阳离子向________ (填“石墨”或“铂”)极迁移。负极反应式为_____________________ 。若忽略体积变化和盐类水解,电路上转移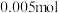 电子,则
电子,则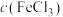
_________ (填“净增”或“净减”)_______  。
。
(3)一段时间后,向石墨极烧杯中加入适量30%双氧水和硫酸,电流计显示:电子由铂极流入石墨极。此时,铂极是___________ (填“正极”或“负极”)。
(4)结合上述(2)、(3)实验现象,可以得出的结论是__________ 。

注明:盐桥为饱和KCl溶液和琼脂,烧杯中溶液均为100mL.
(1)用30%双氧水配制10%的双氧水需要使用的玻璃仪器有
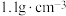 ,该双氧水溶液的物质的量浓度约为
,该双氧水溶液的物质的量浓度约为(2)关闭K,电流计显示电子由石墨极流出经外电路流入铂极。盐桥中阳离子向
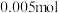 电子,则
电子,则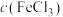
 。
。(3)一段时间后,向石墨极烧杯中加入适量30%双氧水和硫酸,电流计显示:电子由铂极流入石墨极。此时,铂极是
(4)结合上述(2)、(3)实验现象,可以得出的结论是
更新时间:2020/12/11 20:34:02
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO 等)制备K2Cr2O7的流程如图所示。
等)制备K2Cr2O7的流程如图所示。
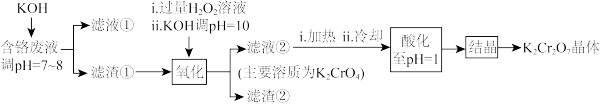
已知:I.在酸性条件下,H2O2能将Cr2O 还原为Cr3+;
还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
请回答下列问题:
(1)滤渣①的主要成分__ 。
(2)加入H2O2的作用是(用离子方程式解释)__ 。
(3)加热的目的是__ 。
(4)“酸化”过程中发生反应的离子方程式为__ ;若该反应的平衡常数K=4×1014L3·mol-3,已知:“酸化”后溶液中c(Cr2O )=1.6×10-3mol·L-1,则溶液中c(CrO
)=1.6×10-3mol·L-1,则溶液中c(CrO )=
)=__ 。
(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为
+6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__ 。(计算结果保留四位有效数字)
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
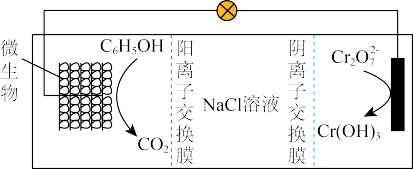
①负极的电极反应式为__ ;
②一段时间后,中间室中NaCl溶液的浓度__ (填“增大”、“减小”或“不变”)。
 等)制备K2Cr2O7的流程如图所示。
等)制备K2Cr2O7的流程如图所示。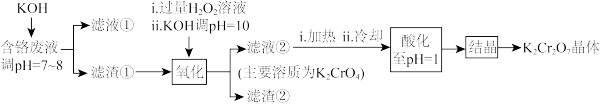
已知:I.在酸性条件下,H2O2能将Cr2O
 还原为Cr3+;
还原为Cr3+;Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 2.8 |
请回答下列问题:
(1)滤渣①的主要成分
(2)加入H2O2的作用是(用离子方程式解释)
(3)加热的目的是
(4)“酸化”过程中发生反应的离子方程式为
 )=1.6×10-3mol·L-1,则溶液中c(CrO
)=1.6×10-3mol·L-1,则溶液中c(CrO )=
)=(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O
 +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为
+6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。

①负极的电极反应式为
②一段时间后,中间室中NaCl溶液的浓度
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]是一种重要化学试剂,实验室可用纯铁片来制取硫酸亚铁铵,流程如图:

请回答下列问题:
(1)操作Ⅰ的名称是___ ,所用主要仪器和用品有___ (铁架台、铁圈除外)。
(2)若A物质为CuSO4,其加入的目的是___ ,则固体B的成分为___ 。
(3)加少量硫酸可以调节pH为1~2,其作用是___ 。
(4)假设在水溶液中硫酸氢钠如此电离:NaHSO4=Na++H++SO 。物质的量浓度相同的①氨水;②氯化铵;③碳酸氢铵;④硫酸氢铵;⑤硫酸铵;⑥硫酸亚铁铵(NH4)2Fe(SO4)2)溶液6种溶液中c(
。物质的量浓度相同的①氨水;②氯化铵;③碳酸氢铵;④硫酸氢铵;⑤硫酸铵;⑥硫酸亚铁铵(NH4)2Fe(SO4)2)溶液6种溶液中c( )由大到小的顺序是
)由大到小的顺序是___ ,溶液pH由大到小的顺序是___ 。

请回答下列问题:
(1)操作Ⅰ的名称是
(2)若A物质为CuSO4,其加入的目的是
(3)加少量硫酸可以调节pH为1~2,其作用是
(4)假设在水溶液中硫酸氢钠如此电离:NaHSO4=Na++H++SO
 。物质的量浓度相同的①氨水;②氯化铵;③碳酸氢铵;④硫酸氢铵;⑤硫酸铵;⑥硫酸亚铁铵(NH4)2Fe(SO4)2)溶液6种溶液中c(
。物质的量浓度相同的①氨水;②氯化铵;③碳酸氢铵;④硫酸氢铵;⑤硫酸铵;⑥硫酸亚铁铵(NH4)2Fe(SO4)2)溶液6种溶液中c( )由大到小的顺序是
)由大到小的顺序是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___ (填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__ ,该条件下氧化性:Fe3+__ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____ 。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___ ,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。
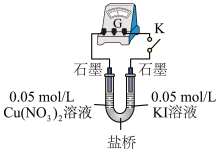
K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___ (填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____ 。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实验 | 现象 | ||
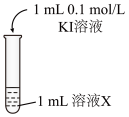 | 编号 | 溶液X | |
| Ⅰ | 0.1mol/LFe(NO3)3,pH≈1 | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
| Ⅱ | KNO3和HNO3,其中c( )=0.3mol/L,pH≈1 )=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
| Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
| Ⅳ | 0.1mol/LCu(NO3)2 | 5秒钟后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
①由“黄色立即加深”初步判断有I2生成,选择
②写出Fe3+与I-反应的离子方程式
③实验Ⅱ的目的是
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】请回答下列问题:
(1)高铁酸钾( )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
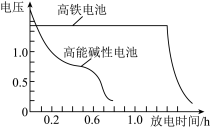
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
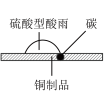
①如图,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生___________ (填“氧化”或“还原”)反应,写出正极的电极反应式:___________ 。 固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有 生成,写出由黑色变为光亮红色过程中反应的化学方程式:
生成,写出由黑色变为光亮红色过程中反应的化学方程式:___________ 。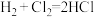 中的某一基元反应为
中的某一基元反应为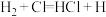 ,其能量变化如图所示。
,其能量变化如图所示。 表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。___________ kJ/mol, 为
为___________ kJ/mol。
(4)键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:
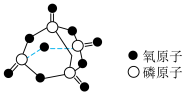
已知白磷的标准燃烧热为-2378kJ/mol,白磷的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中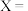
___________ 。
(1)高铁酸钾(
 )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。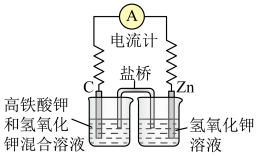
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
①如图,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生
 固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有 生成,写出由黑色变为光亮红色过程中反应的化学方程式:
生成,写出由黑色变为光亮红色过程中反应的化学方程式: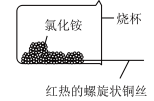
 中的某一基元反应为
中的某一基元反应为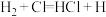 ,其能量变化如图所示。
,其能量变化如图所示。 表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。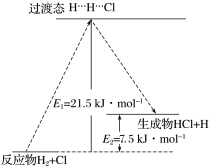
 为
为(4)键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 |  |  |  | 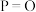 |
| 键能/(kJ/mol) | 172 | 335 | 498 | X |
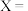
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】电池的种类很多,在生活中有广泛的用途。
Ⅰ.其中纽扣式微型银锌电池广泛的应用于电子表和电子计算器中,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
(1)其正极的电极反应式:_________________________________ ,工作时电池电解质溶液的碱性_______ (填“增强”、“减弱”或“不变”)。
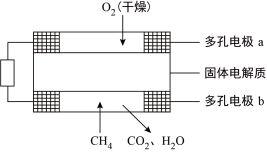
Ⅱ.固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。_______ 极,固体电解质中的阳离子向_______ 极移动;
(3) b电极的电极反应式为:_______________________________________ ;
(4)电池的总反应方程式为:______________________________________ ;
当电路中有2mol电子转移时,理论上负极消耗的标况下气体体积是______________ L。
Ⅰ.其中纽扣式微型银锌电池广泛的应用于电子表和电子计算器中,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
(1)其正极的电极反应式:
Ⅱ.固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。
(3) b电极的电极反应式为:
(4)电池的总反应方程式为:
当电路中有2mol电子转移时,理论上负极消耗的标况下气体体积是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】Ⅰ.如图是某同学设计的一个简易原电池装置。
请回答下列问题。
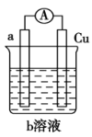
(1)若a电极材料为碳、b溶液为 溶液,则正极的电极反应式为
溶液,则正极的电极反应式为___________ ,当有 负极材料溶解时,转移的电子为
负极材料溶解时,转移的电子为___________  。
。
(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为___________ →___________ (填电极材料,下同),溶液中的 向
向___________ 极移动。
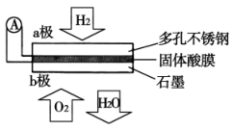
(3)某固体酸膜燃料电池(如图所示)以 固体为电解质传递
固体为电解质传递 ,电池总反应可表示为
,电池总反应可表示为 。则a为电池
。则a为电池___________ 极,b极上的电极反应为___________ 。
Ⅱ.原子间形成化学键放出能量,破坏原子间化学键需要吸收能量。已知 键、
键、 键、
键、 键的键能分别为
键的键能分别为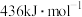 、
、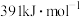 、
、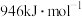 。关于工业合成氨的反应,请根据键能的数据判断下列问题。
。关于工业合成氨的反应,请根据键能的数据判断下列问题。
(4)若有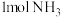 生成,需要
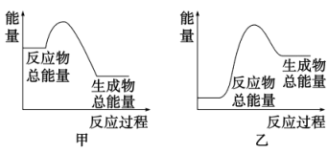
生成,需要___________ (填“吸收”或“放出”)热量___________  ;该反应的能量变化可用图
;该反应的能量变化可用图___________ 表示(填“甲”或“乙”)。
Ⅲ. 在
在 催化下可发生分解反应,为探究一定温度下
催化下可发生分解反应,为探究一定温度下 溶液的浓度、
溶液的浓度、 的浓度对
的浓度对 分解速率的影响,某同学设计了如下实验,内容如下表所示:
分解速率的影响,某同学设计了如下实验,内容如下表所示:
(5)①
___________ 。
②实验甲、乙的探究目的是___________ 。
③实验甲、丙探究催化剂浓度对 分解速率的影响情况,则
分解速率的影响情况,则
___________ ;若实验丙中产生气泡的速率较快,由此可得出的结论是___________ 。
请回答下列问题。

(1)若a电极材料为碳、b溶液为
 溶液,则正极的电极反应式为
溶液,则正极的电极反应式为 负极材料溶解时,转移的电子为
负极材料溶解时,转移的电子为 。
。(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为
 向
向(3)某固体酸膜燃料电池(如图所示)以
 固体为电解质传递
固体为电解质传递 ,电池总反应可表示为
,电池总反应可表示为 。则a为电池
。则a为电池
Ⅱ.原子间形成化学键放出能量,破坏原子间化学键需要吸收能量。已知
 键、
键、 键、
键、 键的键能分别为
键的键能分别为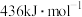 、
、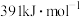 、
、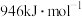 。关于工业合成氨的反应,请根据键能的数据判断下列问题。
。关于工业合成氨的反应,请根据键能的数据判断下列问题。(4)若有
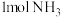 生成,需要
生成,需要 ;该反应的能量变化可用图
;该反应的能量变化可用图
Ⅲ.
 在
在 催化下可发生分解反应,为探究一定温度下
催化下可发生分解反应,为探究一定温度下 溶液的浓度、
溶液的浓度、 的浓度对
的浓度对 分解速率的影响,某同学设计了如下实验,内容如下表所示:
分解速率的影响,某同学设计了如下实验,内容如下表所示:| 实验序号 | 实验所用试剂 | ||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||
 |  |  |  |  | |
| 甲 | 4 | 0.1 | 3 | 2 | 3 |
| 乙 | 4 | 0.1 | 2 | 2 |  |
| 丙 | 5 | 0.1 |  | 2 | 2 |
(5)①

②实验甲、乙的探究目的是
③实验甲、丙探究催化剂浓度对
 分解速率的影响情况,则
分解速率的影响情况,则
您最近一年使用:0次



