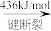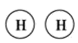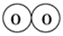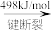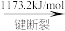在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图象,然后回答问题:
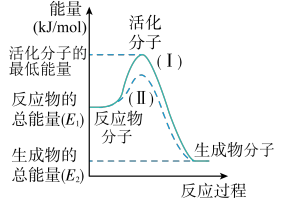
(1)图中所示反应是______ (填“吸热”或“放热”)反应,该反应______ (填“需要”或“不需要”)加热,该反应的ΔH=______ (用含E1、E2的代数式表示 );
);
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是___________ 。
(3)已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g) = 2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g) = 2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1________ ΔH2(填“>”“<”或“=”)。
(4)在298 K、101 kPa时,已知:
2H2O(g)= O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g) = 4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________ 。
A.ΔH3=ΔH1+2ΔH2B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2D.ΔH3=ΔH1-ΔH2
(5)已知H2(g)+Br2(l) = 2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
则表中a=________ 。

(1)图中所示反应是
 );
);(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是
(3)已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g) = 2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g) = 2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1
(4)在298 K、101 kPa时,已知:
2H2O(g)= O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g) = 4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是
A.ΔH3=ΔH1+2ΔH2B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2D.ΔH3=ΔH1-ΔH2
(5)已知H2(g)+Br2(l) = 2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1 mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
更新时间:2020-12-02 17:00:02
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】有科学家预言,氢能将成为21世纪的主要能源之一,而且是一种理想的绿色能源。
(1)氢能被称为绿色能源的原因是_______ (只答一点即可)。
(2)在 下,
下, 完全燃烧生成液态水放出
完全燃烧生成液态水放出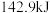 的热量,请回答下列问题:
的热量,请回答下列问题:
①该反应的反应物总能量_______ (填“大于”“小于”或“等于”)生成物总能量。
②氢气的燃烧热为_______ 。
③该反应的热化学方程式为_______ 。
④若 完全燃烧生成
完全燃烧生成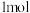 气态水放出
气态水放出 的热量,已知
的热量,已知 的键能为
的键能为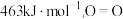 的键能为
的键能为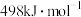 ,计算
,计算 的键能为
的键能为_______  。
。
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金 ,已知:
,已知:
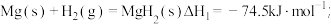


则
_______  。
。
(1)氢能被称为绿色能源的原因是
(2)在
 下,
下,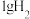 完全燃烧生成液态水放出
完全燃烧生成液态水放出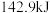 的热量,请回答下列问题:
的热量,请回答下列问题:①该反应的反应物总能量
②氢气的燃烧热为
③该反应的热化学方程式为
④若
 完全燃烧生成
完全燃烧生成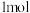 气态水放出
气态水放出 的热量,已知
的热量,已知 的键能为
的键能为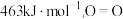 的键能为
的键能为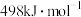 ,计算
,计算 的键能为
的键能为 。
。(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金
 ,已知:
,已知: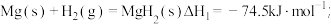


则

 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol“表示。观察下图,回答问题:
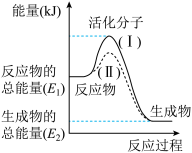
(1)图中所示反应是_______________ (填“吸热”或“放热”)反应。
(2)已知拆开1molH-H键、1molI-I、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ,则由1mol氢气和1mol碘反应生成HI会______ (填“放出”或“吸收”)_____ kJ的热量。在化学反应过程中,将_____ 能转化为____ 能。
(3)下列反应中,属于放热反应的是_____________ ,属于吸热反应的是______________ 。
①物质燃烧;②炸药爆炸;③稀释浓硫酸;④二氧化碳通过炽热的碳⑤食物因氧化而腐败;⑥Ba(OH)2·8H2O与NH4Cl反应;⑦铁粉与稀盐酸反应

(1)图中所示反应是
(2)已知拆开1molH-H键、1molI-I、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ,则由1mol氢气和1mol碘反应生成HI会
(3)下列反应中,属于放热反应的是
①物质燃烧;②炸药爆炸;③稀释浓硫酸;④二氧化碳通过炽热的碳⑤食物因氧化而腐败;⑥Ba(OH)2·8H2O与NH4Cl反应;⑦铁粉与稀盐酸反应
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】 氢氟酸是一种弱酸,可用来刻蚀玻璃。已知
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知 时
时

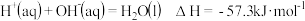
氢氟酸电离的热化学方程式可表示为___________________________________________ ;
氟化氢电离过程“放热”,其主要原因可能是____________________________________ 。
 已知
已知 的第二级电离常数
的第二级电离常数 ,HClO的电离常数
,HClO的电离常数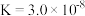
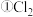 与水反应的化学平衡常数表达式为
与水反应的化学平衡常数表达式为_________________________________________ ;
写出下列条件下所发生反应的离子方程式:
 少量
少量 通入到过量的
通入到过量的 溶液中:
溶液中:_________________________________________ ;
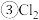 与
与 按物质的量之比
按物质的量之比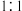 恰好反应:
恰好反应:__________________________________ ;
 少量
少量 通入到过量的NaClO溶液中:
通入到过量的NaClO溶液中:_________________________________________ 。
 氢氟酸是一种弱酸,可用来刻蚀玻璃。已知
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知 时
时 
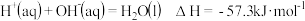
氢氟酸电离的热化学方程式可表示为
氟化氢电离过程“放热”,其主要原因可能是
 已知
已知 的第二级电离常数
的第二级电离常数 ,HClO的电离常数
,HClO的电离常数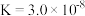
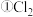 与水反应的化学平衡常数表达式为
与水反应的化学平衡常数表达式为写出下列条件下所发生反应的离子方程式:
 少量
少量 通入到过量的
通入到过量的 溶液中:
溶液中: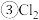 与
与 按物质的量之比
按物质的量之比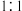 恰好反应:
恰好反应: 少量
少量 通入到过量的NaClO溶液中:
通入到过量的NaClO溶液中:
您最近一年使用:0次
【推荐1】2SO2(g)+ O2(g) 2SO3(g)能量变化如右图所示。 已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g)能量变化如右图所示。 已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:

(1)E的大小对该反应的△H_______ (填“有” 或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________ (填“升高”、“降低”或“不变”),原因是____________________ 。
(2)V2O5 的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化循环机理的两个化学方程式:______ 、_______ 。
(3)已知单质硫的标准燃烧热为296kJ·mol-1,则常温常压下,由单质硫和氧气经两步反应,若生成3mol SO3(g),放出的总热量为___________________________ 。
 2SO3(g)能量变化如右图所示。 已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g)能量变化如右图所示。 已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
(1)E的大小对该反应的△H
(2)V2O5 的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化循环机理的两个化学方程式:
(3)已知单质硫的标准燃烧热为296kJ·mol-1,则常温常压下,由单质硫和氧气经两步反应,若生成3mol SO3(g),放出的总热量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】当溴与1,3-丁二烯在环己烷溶液中发生加成反应时,会得到两个产物A和B(不考虑立体化学)。在-15℃时A和B的比例为62:38;而在25℃时A和B的比例为12:88。
(1)画出化合物A和B的结构简式_____ ;并确定哪个为热力学稳定产物,哪个为动力学产物______ 。
(2)在室温下,A可以缓慢地转化为B.画出此转换过程的反应势能示意图和中间体的结构简式_____ 。
(3)根据以上的研究结果,确定以下反应的产物:
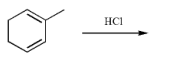
______
(1)画出化合物A和B的结构简式
(2)在室温下,A可以缓慢地转化为B.画出此转换过程的反应势能示意图和中间体的结构简式
(3)根据以上的研究结果,确定以下反应的产物:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】按要求填空。
(1)SiH4是一种无色气体,在空气中能发生爆炸性自燃生成固态SiO2和液态H2O。已知室温下16gSiH4(g)自燃放出热量713.6kJ。写出室温下SiH4(g)自燃的热化学方程式___________ 。
(2)某化学反应中,反应物的总能量为E1,生成物的总能量为E2,且E1<E2,则该反应是___________ (填“放热”或“吸热”)反应
(3)稀溶液中,1molH2SO4与NaOH完全反应时,放出114.6kJ热量,写出表示中和热的热化学方程式___________ 。
(4)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每转移1mole﹣,放热44.4kJ,写出该反应的热化学方程式___________ 。
(5)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图所示。1个P4O10分子中P-O的个数为___________ ,表中x=___________ kJ/mol(用含a、b、c、d的代表数式表示)。

(6)已知:25℃时,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11,HClO的Ka=2.95×10-8,比较结合H+能力的相对强弱:
___________ ClO-(填“>”、“<”或“=”)。
(1)SiH4是一种无色气体,在空气中能发生爆炸性自燃生成固态SiO2和液态H2O。已知室温下16gSiH4(g)自燃放出热量713.6kJ。写出室温下SiH4(g)自燃的热化学方程式
(2)某化学反应中,反应物的总能量为E1,生成物的总能量为E2,且E1<E2,则该反应是
(3)稀溶液中,1molH2SO4与NaOH完全反应时,放出114.6kJ热量,写出表示中和热的热化学方程式
(4)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每转移1mole﹣,放热44.4kJ,写出该反应的热化学方程式
(5)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ/mol | a | b | c | x |

(6)已知:25℃时,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11,HClO的Ka=2.95×10-8,比较结合H+能力的相对强弱:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】 在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:

(1)下列说法正确的是___________(填字母)。
(2)生成 的化学方程式为
的化学方程式为___________ 。
(3) 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、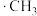 )反应,包括以下几步:
)反应,包括以下几步:
①写出由 生成
生成 过程中链传递的方程式:
过程中链传递的方程式: 、
、___________ 。
②已知:25℃、 时,
时, 中
中 键和
键和 中
中 键的键能分别是
键的键能分别是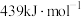 和
和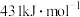 。则反应
。则反应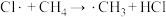 完全反应
完全反应___________ (填“放出”或“吸收”)热量。
(4)丙烷氯代反应中链传递的一步反应能量变化如图。
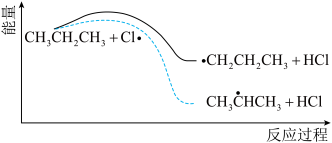
分析上图可知, 中
中 键能比
键能比 中
中 键能
键能___________ (填“大”或“小”)。
 在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
(1)下列说法正确的是___________(填字母)。
| A.反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生 |
B.将该装置放在黑暗处, 与 与 也能反应 也能反应 |
| C.该实验可得到五种产物 |
D. 和 和 完全反应后试管内液面上升,液体充满试管 完全反应后试管内液面上升,液体充满试管 |
(2)生成
 的化学方程式为
的化学方程式为(3)
 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、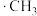 )反应,包括以下几步:
)反应,包括以下几步:| Ⅰ.链引发 | Ⅱ.链传递 | Ⅲ.链终止 |
 | 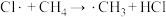 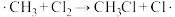 … |   … |
 生成
生成 过程中链传递的方程式:
过程中链传递的方程式: 、
、②已知:25℃、
 时,
时, 中
中 键和
键和 中
中 键的键能分别是
键的键能分别是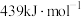 和
和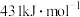 。则反应
。则反应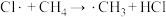 完全反应
完全反应(4)丙烷氯代反应中链传递的一步反应能量变化如图。

分析上图可知,
 中
中 键能比
键能比 中
中 键能
键能
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某些化学键的键能如下表所示(单位kJ·mol-1):
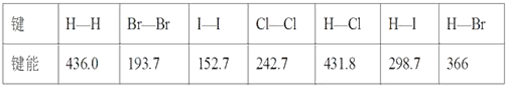
(1)1 mol H2在2 mol Cl2中燃烧,放出的热量为____ kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是________ 。
A.Cl2>Br2>I2 B.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在足量Cl2中燃烧放热________________ (填“多”或“少”)。

(1)1 mol H2在2 mol Cl2中燃烧,放出的热量为
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是
A.Cl2>Br2>I2 B.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在足量Cl2中燃烧放热
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】由下表数据计算CO分子中的键能为___________ ,并根据该数据写出CO的电子式和结构式___________ 。
| CO燃烧热 |  中键能 中键能 |  中 中 键能 键能 |
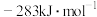 | 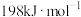 | 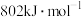 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】完成下列问题
(1)用CH4催化还原NOx可以消除氮氧化物的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1= - 574kJ/mol
CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(g) △H2
若1molCH4还原NO2制N2,整个过程中放出的热量为867kJ,则△H2=_______ 。
(2)根据盖斯提出的“不管化学过程是一步完成或几步完成这个总过程的热效应是相等的”观点来计算反应热。已知:
C(石墨,s)+O2(g)=CO2(g) △H1= -393.5kJ/mol
C(金刚石,s)+O2(g)=CO2(g) △H2= -395.0kJ/mol
则石墨的稳定性比金刚石_______ (填“高”或“低”)
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;
②CO(g)+2H2(g) CH3OH(g) △H2;
CH3OH(g) △H2;
③CO2(g)+H2(g) CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
回答下列问题:
已知反应①中的相关的化学键键能(“C O”表示CO的化学键)数据见表:由此计算△H2=
O”表示CO的化学键)数据见表:由此计算△H2=_______ kJ·mol-1,已知△H1=-58kJ·mol-1,则△H3=_______ kJ·mol-1。
(1)用CH4催化还原NOx可以消除氮氧化物的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1= - 574kJ/mol
CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(g) △H2
若1molCH4还原NO2制N2,整个过程中放出的热量为867kJ,则△H2=
(2)根据盖斯提出的“不管化学过程是一步完成或几步完成这个总过程的热效应是相等的”观点来计算反应热。已知:
C(石墨,s)+O2(g)=CO2(g) △H1= -393.5kJ/mol
C(金刚石,s)+O2(g)=CO2(g) △H2= -395.0kJ/mol
则石墨的稳定性比金刚石
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)
 CH3OH(g) △H2;
CH3OH(g) △H2;③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;回答下列问题:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
 O”表示CO的化学键)数据见表:由此计算△H2=
O”表示CO的化学键)数据见表:由此计算△H2=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)已知H2(g)+ O2(g)=H2O(l)ΔH=-285.8kJ•mol-1。蒸发1mol液态水需要吸收的能量为44kJ,其它相关数据如下表:
O2(g)=H2O(l)ΔH=-285.8kJ•mol-1。蒸发1mol液态水需要吸收的能量为44kJ,其它相关数据如下表:
则表中x的大小为______________ ;
(2)已知7.8g乙炔气体充分燃烧时生成CO2和液态水,放出390kJ的热量,则表示乙炔燃烧热的热化学方程式为______________ 。
 O2(g)=H2O(l)ΔH=-285.8kJ•mol-1。蒸发1mol液态水需要吸收的能量为44kJ,其它相关数据如下表:
O2(g)=H2O(l)ΔH=-285.8kJ•mol-1。蒸发1mol液态水需要吸收的能量为44kJ,其它相关数据如下表:| H2(g) | O2(g) | H2O(g) | |
| 1mol分子断裂化学键时需要吸收的能量/kJ | 436 | x | 926 |
则表中x的大小为
(2)已知7.8g乙炔气体充分燃烧时生成CO2和液态水,放出390kJ的热量,则表示乙炔燃烧热的热化学方程式为
您最近一年使用:0次