下图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童___________ 元素含量偏低。
(2)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
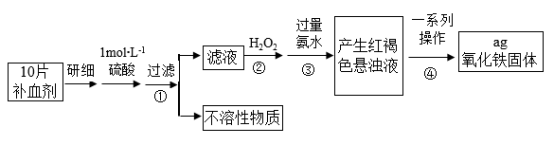
请回答下列问题:
a.②中加入H2O2后发生的反应的离子方程式___________ 。
b.④中一系列处理的操作步骤为___________ 、___________ 、灼烧、冷却、称量。
c.若实验无损耗,则每片补血剂含铁元素的质量分数为___________ 。
怀化市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ | mmol·L-1 | 7.52~11.82 |
3 | 钙(Ca) | 1.68 | mmol·L-1 | 1.55~2.10 |
(1)该儿童
(2)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:

请回答下列问题:
a.②中加入H2O2后发生的反应的离子方程式
b.④中一系列处理的操作步骤为
c.若实验无损耗,则每片补血剂含铁元素的质量分数为
更新时间:2020-12-28 09:52:01
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】I.某化学课外活动小组需检验茶叶中铁元素,设计了如图实验方案:

请回答:
(1)灼烧用的主要仪器是_______ 。
(2)加入6 mol L-1的盐酸时为了加快铁元素的浸出速度,可采取的方法有_______ 、_______ 。
(3)通过血红色溶液不能说明茶叶中的铁元素一定是+3价的,原因是(用方程式表示)_______ 。
II.乙酸乙酯广泛用于药物、染料,香料等工业。甲乙两同学分别设计了如图装置来制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1 ℃,CH3CH2OH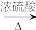 CH2=CH2↑+H2O
CH2=CH2↑+H2O
(1)甲装置中右边导管未插入溶液中的目的是_______ 。
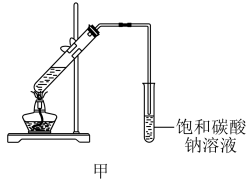
(2)实验结束后分离出乙酸乙酯的操作是(填名称)_______ ,必须用到的玻璃仪器有_______ (从下面选项中选择)。
A.烧杯 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶
(3)乙装置优于甲装置的理由_______ (写两条)。
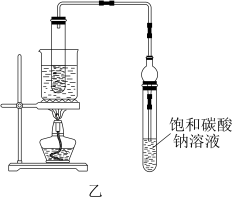
(4)上述实验中饱和碳酸钠溶液的作用是_______ (填字母) 。
a.中和乙酸并吸收乙醇 b.中和乙酸和乙醇
c.减少乙酸乙酯的溶解 d加速酯的生成,提高其产率
(5)实验结束后振荡盛装饱和碳酸钠溶液的试管,振荡前后所观察到的现象分别为_______ 。

请回答:
(1)灼烧用的主要仪器是
(2)加入6 mol L-1的盐酸时为了加快铁元素的浸出速度,可采取的方法有
(3)通过血红色溶液不能说明茶叶中的铁元素一定是+3价的,原因是(用方程式表示)
II.乙酸乙酯广泛用于药物、染料,香料等工业。甲乙两同学分别设计了如图装置来制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1 ℃,CH3CH2OH
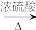 CH2=CH2↑+H2O
CH2=CH2↑+H2O(1)甲装置中右边导管未插入溶液中的目的是

(2)实验结束后分离出乙酸乙酯的操作是(填名称)
A.烧杯 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶
(3)乙装置优于甲装置的理由

(4)上述实验中饱和碳酸钠溶液的作用是
a.中和乙酸并吸收乙醇 b.中和乙酸和乙醇
c.减少乙酸乙酯的溶解 d加速酯的生成,提高其产率
(5)实验结束后振荡盛装饱和碳酸钠溶液的试管,振荡前后所观察到的现象分别为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(1)有“中华第一剑”之称的虢国玉柄铁剑是我国目前出土的最早冶炼铁,玉柄铁剑,剑断锈连,剑身表面的铁锈的主要成分是___ (填标号)。
(2)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是___ (用离子方程式表示)。
(3)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液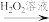 溶液I
溶液I 沉淀II
沉淀II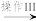 Fe2O3
Fe2O3
①H2O2溶液的作用是___ 。
②“溶液I”的溶质为___ (填化学式),写出由“溶液I”到“沉淀II”反应的离子方程式:___ 。
③“操作III”的名称为___ 。
(4)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:__ (填标号);重复上述操作步骤,直至装置A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=___ (列出计算式即可)。
(1)有“中华第一剑”之称的虢国玉柄铁剑是我国目前出土的最早冶炼铁,玉柄铁剑,剑断锈连,剑身表面的铁锈的主要成分是
| A.Fe | B.FeO | C.Fe3O4 | D.Fe2O3 |
(3)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液
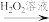 溶液I
溶液I 沉淀II
沉淀II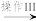 Fe2O3
Fe2O3①H2O2溶液的作用是
②“溶液I”的溶质为
③“操作III”的名称为
(4)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】硫酸亚铁晶体(FeSO4·7H2O)是医药上补血剂的有效成分。某课外小组测定该补血剂中铁元素含量的流程如下(已知其它成分在测定过程中不参与反应),回答下列问题。
(1)写出铁原子的原子结构示意图______________________ 。
(2)步骤①研细的目的是______________________________ 。
(3)证明步骤②滤液中含有Fe2+的方法是___________________ 。
(4)步骤③加入H2O2的目的是______________ ,发生反应的离子方程式是______________ 。
(5)步骤④中一系列操作依次是_______________ 、洗涤、_______________ 、冷却、称量。
(6)假设实验无损耗,正常人每天应补充16.8mg左右的铁,如果全部通过服用上述测定的补血剂片来补充,则正常人每天需服用上述补血剂__________ 片。

(1)写出铁原子的原子结构示意图
(2)步骤①研细的目的是
(3)证明步骤②滤液中含有Fe2+的方法是
(4)步骤③加入H2O2的目的是
(5)步骤④中一系列操作依次是
(6)假设实验无损耗,正常人每天应补充16.8mg左右的铁,如果全部通过服用上述测定的补血剂片来补充,则正常人每天需服用上述补血剂
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
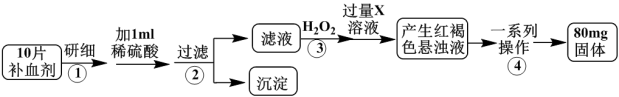
【推荐1】实验室用燃烧法测定某种氨基酸( )的分子组成。将W g该种氨基酸放在纯氧中充分燃烧,生成
)的分子组成。将W g该种氨基酸放在纯氧中充分燃烧,生成 、
、 和
和 ,现按如图所示的装置进行实验:
,现按如图所示的装置进行实验:
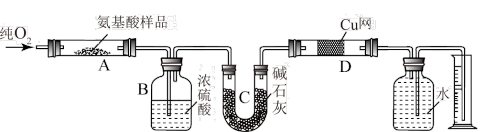
试回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是_______ 。
(2)以上装置中需要加热的仪器有_____ ,操作时应先点燃________ 处的酒精灯。
(3)A装置中发生反应的化学方程式为_______ 。
(4)装置D的作用是___________ 。
(5)读取 体积时,应注意:
体积时,应注意:
①_______ ;
②___________ ;
③____________ 。
(6)实验中测得 的体积为
的体积为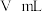 (已换算为标准状况下的体积)。为确定此氨基酸的分子式,还需要的有关数据是
(已换算为标准状况下的体积)。为确定此氨基酸的分子式,还需要的有关数据是_____ (填序号)。
A 生成二氧化碳气体的质量 B 生成水的质量
C 通入氧气的体积 D 氨基酸的相对分子质量
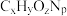 )的分子组成。将W g该种氨基酸放在纯氧中充分燃烧,生成
)的分子组成。将W g该种氨基酸放在纯氧中充分燃烧,生成 、
、 和
和 ,现按如图所示的装置进行实验:
,现按如图所示的装置进行实验:
试回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是
(2)以上装置中需要加热的仪器有
(3)A装置中发生反应的化学方程式为
(4)装置D的作用是
(5)读取
 体积时,应注意:
体积时,应注意:①
②
③
(6)实验中测得
 的体积为
的体积为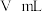 (已换算为标准状况下的体积)。为确定此氨基酸的分子式,还需要的有关数据是
(已换算为标准状况下的体积)。为确定此氨基酸的分子式,还需要的有关数据是A 生成二氧化碳气体的质量 B 生成水的质量
C 通入氧气的体积 D 氨基酸的相对分子质量
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】钠的化合物在日常生活中的应用非常广泛。为了测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,某同学用如下实验装置完成实验。请回答下列问题:
(1)实验前首先要进行的操作是___________ 。
(2)某同学称取 混合物于锥形瓶中,打开止水夹,通入
混合物于锥形瓶中,打开止水夹,通入 ,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间
,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间 。停止通
。停止通 ,装置C的质量增加
,装置C的质量增加 。
。
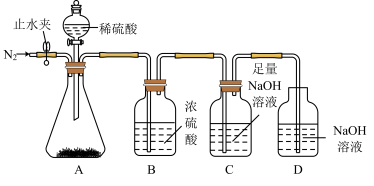
①两次通入N2的目的分别是___________ 、___________ 。
②混合物中Na2CO3的质量分数为___________ 。
(1)实验前首先要进行的操作是
(2)某同学称取
 混合物于锥形瓶中,打开止水夹,通入
混合物于锥形瓶中,打开止水夹,通入 ,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间
,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间 。停止通
。停止通 ,装置C的质量增加
,装置C的质量增加 。
。
①两次通入N2的目的分别是
②混合物中Na2CO3的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】硫酸是在工业生产中极为重要的一种化工产品,而硫酸的浓度不同,性质也会不同。现有甲、乙两研究小组分别进行了如下实验探究:
I.甲研究小组按下图装置进行实验,验证锌与浓硫酸反应生成物中的气体成分,取足量的Zn置于b中,向a中加入适量浓硫酸,经过一段时间的反应,Zn仍有剩余。_______ 。
(2)在反应初始阶段 ,装置A中发生的化学方程式为_______ 。
(3)装置C中若为酸性高锰酸钾溶液,则对应的离子方程式 为_____ 。
(4)装置G的名称为U形管,其作用为______ 。
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为______ 。
Ⅱ.乙研究小组为了利用稀硫酸制备CuSO4,进行了如下图所示的实验设计。
①2Fe3+ + Cu = 2Fe2+ + Cu2+
②∙∙∙∙∙∙
(6)反应②的离子方程式 为______ 。
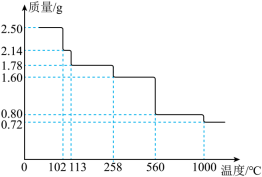
(7)取CuSO4·5H2O晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示,当达到120℃时,固体的成分为_______ 。
I.甲研究小组按下图装置进行实验,验证锌与浓硫酸反应生成物中的气体成分,取足量的Zn置于b中,向a中加入适量浓硫酸,经过一段时间的反应,Zn仍有剩余。
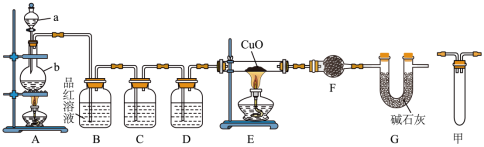
(2)在
(3)装置C中若为酸性高锰酸钾溶液,则对应的
(4)装置G的名称为U形管,其作用为
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为
Ⅱ.乙研究小组为了利用稀硫酸制备CuSO4,进行了如下图所示的实验设计。

①2Fe3+ + Cu = 2Fe2+ + Cu2+
②∙∙∙∙∙∙
(6)反应②的
(7)取CuSO4·5H2O晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示,当达到120℃时,固体的成分为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】实验室利用甲苯(PhCH3,Ph−代表苯基)为原料制备苯甲酸(PhCOOH)。
I. 制备原理:
氧化:PhCH3+2KMnO4→PhCOOK+2MnO2↓+KOH+H2O
酸化:PhCOOK+HCl→PhCOOH+KCl
II. 实验流程:

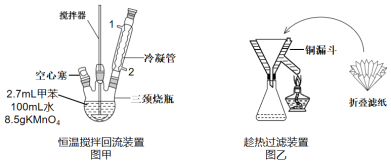
Ⅲ. 步骤①(图甲)、步骤③(图乙)实验装置:
Ⅳ.相关数据:
请回答:
(1)图甲装置中,冷凝管进水口为___________ (填1或2);图乙装置中“折叠”滤纸的优点是___________ 。
(2)有关步骤①,下列说法正确的是___________。
(3)步骤②中,除去多余KMnO4反应的离子方程式为___________ 。
(4)步骤⑦中,洗涤时用冷水的目的是___________ 。
(5)产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞试液,然后用0.1000 mol∙L−1 KOH溶液滴定,到达滴定终点时消耗KOH溶液24.00mL。产品苯甲酸的纯度为___________ 。
I. 制备原理:
氧化:PhCH3+2KMnO4→PhCOOK+2MnO2↓+KOH+H2O
酸化:PhCOOK+HCl→PhCOOH+KCl
II. 实验流程:

Ⅲ. 步骤①(图甲)、步骤③(图乙)实验装置:

Ⅳ.相关数据:
| 物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | −94.9 | 110.6 | 0.87 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 122 | 249 | 1.27 | 微溶 | 易溶 |
| 附:苯甲酸在水中的溶解度g/100g水:0.34(25℃)、0.85(50℃)、2.2(75℃)。 | ||||||
(1)图甲装置中,冷凝管进水口为
(2)有关步骤①,下列说法正确的是___________。
| A.甲苯与KMnO4溶液互不相溶,搅拌可增大两相反应接触面积 |
| B.球形冷凝管的内芯管为球泡状,冷却面积大,可用于蒸馏实验 |
| C.控制反应温度,以蒸气上升至内芯管上端为宜 |
| D.当甲苯层消失,回流液无油珠,表明反应完全 |
(4)步骤⑦中,洗涤时用冷水的目的是
(5)产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞试液,然后用0.1000 mol∙L−1 KOH溶液滴定,到达滴定终点时消耗KOH溶液24.00mL。产品苯甲酸的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。
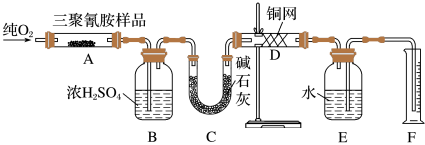
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____ 。
(2)需要加热的装置是____ (填字母代号)。
(3)装置D的作用是_____ 。
(4)F处读数时应该注意的是____ 、_____ 。
(5)三聚氰胺的分子式为____ 。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是
(2)需要加热的装置是
(3)装置D的作用是
(4)F处读数时应该注意的是
(5)三聚氰胺的分子式为
您最近一年使用:0次
【推荐3】(1)砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O。
①反应中还原剂是______________ ,(用化学式回答)若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为_________ L。
②用双线桥法标出上述反应中电子转移的方向和数目____________ 。
(2)某同学用含少量硫酸铁的硫酸钠固体,制取芒硝(Na2SO4·10H2O),操作流程图如下所示,请回答下列问题:
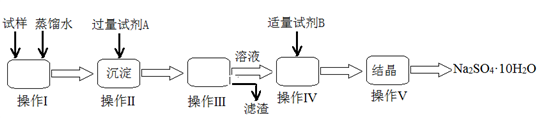
①操作III所需的玻璃仪器有__________ 。操作V的步骤依次是______ (用编号填入)
a.过滤 b.冷却、结晶 c.蒸发浓缩 d.蒸发至接近蒸干
②试剂A为_______ ;试剂B为______ ,实验中加入适量试剂B的实验方法为_____________ 。
①反应中还原剂是
②用双线桥法标出上述反应中电子转移的方向和数目
(2)某同学用含少量硫酸铁的硫酸钠固体,制取芒硝(Na2SO4·10H2O),操作流程图如下所示,请回答下列问题:

①操作III所需的玻璃仪器有
a.过滤 b.冷却、结晶 c.蒸发浓缩 d.蒸发至接近蒸干
②试剂A为
您最近一年使用:0次

 mol·L-1
mol·L-1

