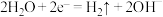已知Ca(OH)2饱和溶液中存在沉淀溶解平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个
Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个
①升高温度,该沉淀溶解平衡逆向移动
②向溶液中加入少量Na2CO3粉末能增大Ca2+浓度
③恒温条件下,向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加入Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
 Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个
Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个①升高温度,该沉淀溶解平衡逆向移动
②向溶液中加入少量Na2CO3粉末能增大Ca2+浓度
③恒温条件下,向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加入Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
| A.2 | B.3 | C.4 | D.5 |
更新时间:2021/01/02 20:30:05
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】有关下列图像的分析正确的是


A.图①表示在 达到平衡后,减少 达到平衡后,减少 浓度时速率的变化 浓度时速率的变化 |
B.图②中a、b曲线分别表示反应 在有催化剂和无催化剂存在下建立平衡的过程 在有催化剂和无催化剂存在下建立平衡的过程 |
| C.图③说明酸HA是比酸HB更弱的酸 |
| D.图④表示AgBr在水中的沉淀溶解平衡曲线,在AgBr饱和溶液中加入固体NaBr,可使c点变到b点 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法中正确的是
| A.难溶物的Ksp越小,该物质的溶解度越小 |
| B.某离子被沉淀完全是指该离子在溶液中的物质的量为0 |
| C.在氢氧化镁悬浊液中滴入饱和氯化铁溶液,产生红褐色沉淀 |
| D.难溶物不能转化为易溶物 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】已知:①AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。
②室温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2S)=2.0×10-48。
向AgCl的悬浊液中加入一定量的Na2S溶液并振荡,白色固体向黑色固体转化。下列说法正确的是
②室温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2S)=2.0×10-48。
向AgCl的悬浊液中加入一定量的Na2S溶液并振荡,白色固体向黑色固体转化。下列说法正确的是
| A.Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(S2-) |
| B.向AgCl悬浊液加入足量氨水,溶液变澄清。反应的离子方程式为:AgCl+4NH3•H2O=[Ag(NH3)4]++Cl-+4H2O |
C.反应2AgCl+S2- Ag2S+2Cl-正向进行,需满足 Ag2S+2Cl-正向进行,需满足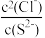 <2×1028 <2×1028 |
D.将转化后的体系静置,上层清液中离子存在关系:c(Ag+)=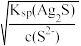 且c(Ag+)> 且c(Ag+)>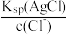 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是
| A.沉淀的速率和溶解的速率相等 |
| B.难溶电解质在水中形成饱和溶液 |
| C.再加入难溶电解质,溶液中各离子的浓度不变 |
| D.难溶电解质溶解形成的阴、阳离子的浓度相等 |
您最近一年使用:0次
单选题-单题
|
适中
(0.65)
【推荐2】已知:(i)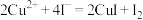 ;
;
(ii)CuI为白色沉淀,CuOH为橙色沉淀,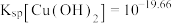 。
。
现进行如下实验:
①将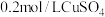 溶液与
溶液与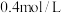 KI溶液等体积混合,充分反应后过滤,测得滤液
KI溶液等体积混合,充分反应后过滤,测得滤液 ;
;
②向滤液中滴加1滴稀NaOH溶液,出现白色沉淀;
③继续滴加NaOH溶液,数滴后又出现蓝色沉淀。
对该实验的解释不正确的是
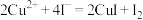 ;
;(ii)CuI为白色沉淀,CuOH为橙色沉淀,
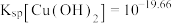 。
。现进行如下实验:
①将
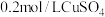 溶液与
溶液与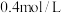 KI溶液等体积混合,充分反应后过滤,测得滤液
KI溶液等体积混合,充分反应后过滤,测得滤液 ;
;②向滤液中滴加1滴稀NaOH溶液,出现白色沉淀;
③继续滴加NaOH溶液,数滴后又出现蓝色沉淀。
对该实验的解释不正确的是
| A.①充分反应后可观察到白色沉淀和棕黄色溶液 |
B.②中未生成蓝色沉淀,说明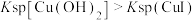 |
| C.③中出现蓝色沉淀时,反应(i)中的平衡可能逆向移动 |
D.无论②还是③,随着NaOH溶液的加入, 始终降低 始终降低 |
您最近一年使用:0次

 溶液中滴入过量氨水:
溶液中滴入过量氨水: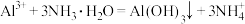
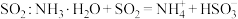
 浊液中加入
浊液中加入 溶液,生成红褐色沉淀:
溶液,生成红褐色沉淀: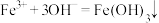
 的阴极反应:
的阴极反应: