制取亚氯酸钠( )晶体装置如图:
)晶体装置如图:
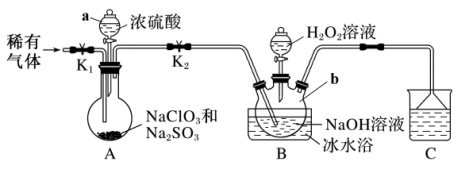
已知:纯 易分解爆炸,一般用稀有气体稀释到
易分解爆炸,一般用稀有气体稀释到 以下。
以下。
(1)仪器 的名称为
的名称为___________ ,仪器 的名称为
的名称为___________ 。
(2)装置 中产生
中产生 的化学方程式为
的化学方程式为___________ 。
(3)实验过程中需要持续通入稀有气体,目的是___________ 。
(4)装置 中制取
中制取 的化学方程式为
的化学方程式为___________ 。
(5)用装置 吸收
吸收 ,倒扣漏斗的作用是
,倒扣漏斗的作用是___________ 。
(6)测定亚氯酸钠的含量实验步骤:①称取亚氯酸钠样品 于小烧杯中,加入适量蒸馏水和过量的
于小烧杯中,加入适量蒸馏水和过量的 晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成
晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成 待测溶液。②移取
待测溶液。②移取 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用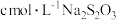 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液体积为
标准溶液体积为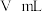 。(已知:
。(已知: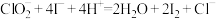 、
、 )
)
①达到滴定终点时的现象为___________ 。
②该样品中 的质量分数为
的质量分数为___________ (用含m、c、V的代数式表示,结果化简成最简式,三位有效数字)。
 )晶体装置如图:
)晶体装置如图:
已知:纯
 易分解爆炸,一般用稀有气体稀释到
易分解爆炸,一般用稀有气体稀释到 以下。
以下。(1)仪器
 的名称为
的名称为 的名称为
的名称为(2)装置
 中产生
中产生 的化学方程式为
的化学方程式为(3)实验过程中需要持续通入稀有气体,目的是
(4)装置
 中制取
中制取 的化学方程式为
的化学方程式为(5)用装置
 吸收
吸收 ,倒扣漏斗的作用是
,倒扣漏斗的作用是(6)测定亚氯酸钠的含量实验步骤:①称取亚氯酸钠样品
 于小烧杯中,加入适量蒸馏水和过量的
于小烧杯中,加入适量蒸馏水和过量的 晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成
晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成 待测溶液。②移取
待测溶液。②移取 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用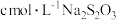 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液体积为
标准溶液体积为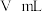 。(已知:
。(已知: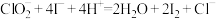 、
、 )
)①达到滴定终点时的现象为
②该样品中
 的质量分数为
的质量分数为
21-22高三上·辽宁沈阳·期末 查看更多[2]
更新时间:2021-01-10 15:51:09
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】草酸(分子式为H2C2O4)是重要的有机还原剂和漂白剂,在工农业、医学及生物学中具有重要作用。实验室的草酸晶体一般带结晶水,分子式为H2C2O4•2H2O(相对分子质量为126)。
已知:①草酸是二元弱酸,弱酸电离度一般小于10%;②草酸遇酸性溶液生成CO2。
回答下列问题:
(1)1分子草酸中含有_____ 个σ键。
(2)实验室有草酸晶体,可用酸性KMnO4溶液测定草酸晶体的纯度(杂质对实验无影响):称取实验室中的草酸晶体1.40g,溶于水配制成100mL溶液。取20.00mL所配溶液于锥形瓶中,用0.032mol•L-1的酸性KMnO4溶液滴定,滴定至终点时消耗KMnO4溶液25.00mL。
①写出草酸溶液与酸性KMnO4溶液反应的离子方程式:_____ 。
②滴定终点的标志是_____ 。
③实验草酸晶体的纯度为_____ %。
(3)可利用草酸与酸性KMnO4溶液反应分析浓度对化学反应速率的影响。
可选择的药品:0.032mol•L-1酸性KMnO4溶液、0.100mol•L-1草酸溶液蒸馏水。
某同学实验记录如表:
①实验1的速率v1(KMnO4)_____ 实验2的速率v2(KMnO4)(填“>”、“<”或“=”)。
②请完成如表实验设计:
其中b=_____ ,实验结果:t2<t1,结论:_____ 。
(4)设计一个简单实验证明草酸是弱酸:_____ 。
已知:①草酸是二元弱酸,弱酸电离度一般小于10%;②草酸遇酸性溶液生成CO2。
回答下列问题:
(1)1分子草酸中含有
(2)实验室有草酸晶体,可用酸性KMnO4溶液测定草酸晶体的纯度(杂质对实验无影响):称取实验室中的草酸晶体1.40g,溶于水配制成100mL溶液。取20.00mL所配溶液于锥形瓶中,用0.032mol•L-1的酸性KMnO4溶液滴定,滴定至终点时消耗KMnO4溶液25.00mL。
①写出草酸溶液与酸性KMnO4溶液反应的离子方程式:
②滴定终点的标志是
③实验草酸晶体的纯度为
(3)可利用草酸与酸性KMnO4溶液反应分析浓度对化学反应速率的影响。
可选择的药品:0.032mol•L-1酸性KMnO4溶液、0.100mol•L-1草酸溶液蒸馏水。
某同学实验记录如表:
| 实验序号 | 酸性KMnO4溶液体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL | 溶液褪色时间/s |
| 1 | 2 | 10 | 3 | 30 |
| 2 | 5 | 10 | 0 | 45 |
②请完成如表实验设计:
| 实验序号 | 酸性KMnO4溶液体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL | 溶液褪色时间/s |
| 1 | 2 | 5 | 10 |  |
| 2 | a | b | 0 |  |
(4)设计一个简单实验证明草酸是弱酸:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】 可用于面粉的漂白和杀菌。已知:
可用于面粉的漂白和杀菌。已知: 为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。
为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。
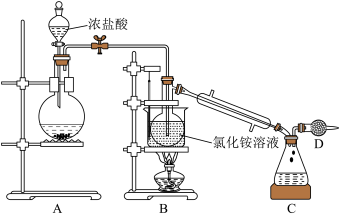
Ⅰ.实验室可用 和
和 溶液反应制取
溶液反应制取 ,所用装置如图:
,所用装置如图:
完成下列填空:
(1)三卤化氮( )的分子空间构型与
)的分子空间构型与 相似,热稳定性比
相似,热稳定性比 强的
强的 有
有_______ 。
(2)仪器D的作用是_______ 。
(3)向蒸馏烧瓶内的 溶液中通入过量
溶液中通入过量 ,B中反应的化学方程式为
,B中反应的化学方程式为_______ ,待反应至油状液体不再增加,关闭装置A、B间的止水夹,控制水浴加热的温度范围为_______ ,将产品 蒸出。
蒸出。
Ⅱ.待反应结束,为测定溶液中残留的的物质的量浓度,进行如下操作:
ⅰ.取蒸馏烧瓶中的反应液25.00mL,加入过量饱和 溶液充分反应后,再加入过量30%的NaOH溶液,微热;
溶液充分反应后,再加入过量30%的NaOH溶液,微热;
ⅱ.用15.00mL 的稀硫酸吸收产生的
的稀硫酸吸收产生的 ,得到溶液A;
,得到溶液A;
ⅲ.用 的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。
的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。
(4)滴定至终点时溶液中溶质仅有 和
和 ,用含V的代数式表示残留液中
,用含V的代数式表示残留液中 的物质的量浓度为
的物质的量浓度为_______  。
。
(5)为减小误差,滴定时最适宜的指示剂为_______(选填序号)。
 可用于面粉的漂白和杀菌。已知:
可用于面粉的漂白和杀菌。已知: 为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。
为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。Ⅰ.实验室可用
 和
和 溶液反应制取
溶液反应制取 ,所用装置如图:
,所用装置如图:
完成下列填空:
(1)三卤化氮(
 )的分子空间构型与
)的分子空间构型与 相似,热稳定性比
相似,热稳定性比 强的
强的 有
有(2)仪器D的作用是
(3)向蒸馏烧瓶内的
 溶液中通入过量
溶液中通入过量 ,B中反应的化学方程式为
,B中反应的化学方程式为 蒸出。
蒸出。Ⅱ.待反应结束,为测定溶液中残留的的物质的量浓度,进行如下操作:
ⅰ.取蒸馏烧瓶中的反应液25.00mL,加入过量饱和
 溶液充分反应后,再加入过量30%的NaOH溶液,微热;
溶液充分反应后,再加入过量30%的NaOH溶液,微热;ⅱ.用15.00mL
 的稀硫酸吸收产生的
的稀硫酸吸收产生的 ,得到溶液A;
,得到溶液A;ⅲ.用
 的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。
的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。(4)滴定至终点时溶液中溶质仅有
 和
和 ,用含V的代数式表示残留液中
,用含V的代数式表示残留液中 的物质的量浓度为
的物质的量浓度为 。
。(5)为减小误差,滴定时最适宜的指示剂为_______(选填序号)。
| A.酚酞 | B.甲基橙 | C.石蕊 | D.淀粉溶液 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】硫代硫酸钠(Na2S2O3·5H2O,M=248g·mol-1)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体并测定其产品的纯度。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,遇酸易分解
②向Na2CO3和Na2S的混合溶液中通入SO2可制得Na2S2O3
实验装置如图所示(省略夹持装置):

I.制备硫代硫酸钠。
(1)检查装置气密性,然后按图示加入试剂。装置D的作用是_____ ;装置E中应盛放的试剂是___ 。
(2)装置A中发生反应的化学方程式为____ 。
(3)装置C中发生反应的化学方程式为____ 。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤装置C中混合物,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。洗涤时为尽可能避免产品损失,应选用的试剂是______ (填字母序号)。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
II.测定硫代硫酸钠产品的纯度。
(5)该小组称取5.0g产品配成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入25.00mL0.01mol·L-1KIO3溶液,再加入过量的KI溶液并酸化,发生反应的离子方程式为_______ ;然后加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应:I2+2 =2I-+
=2I-+ ,当达到滴定终点时,消耗Na2S2O3溶液20.00 mL。
,当达到滴定终点时,消耗Na2S2O3溶液20.00 mL。
①滴定终点的现象是_________ ;
②该产品的纯度是_______ 。
①Na2S2O3·5H2O是无色透明晶体,易溶于水,遇酸易分解
②向Na2CO3和Na2S的混合溶液中通入SO2可制得Na2S2O3
实验装置如图所示(省略夹持装置):

I.制备硫代硫酸钠。
(1)检查装置气密性,然后按图示加入试剂。装置D的作用是
(2)装置A中发生反应的化学方程式为
(3)装置C中发生反应的化学方程式为
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤装置C中混合物,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。洗涤时为尽可能避免产品损失,应选用的试剂是
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
II.测定硫代硫酸钠产品的纯度。
(5)该小组称取5.0g产品配成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入25.00mL0.01mol·L-1KIO3溶液,再加入过量的KI溶液并酸化,发生反应的离子方程式为
 =2I-+
=2I-+ ,当达到滴定终点时,消耗Na2S2O3溶液20.00 mL。
,当达到滴定终点时,消耗Na2S2O3溶液20.00 mL。①滴定终点的现象是
②该产品的纯度是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】根据要求,回答下列问题:
I.为认识铁及其化合物的性质和分散系的性质,化学兴趣小组的同学做了如下一组综合实验。
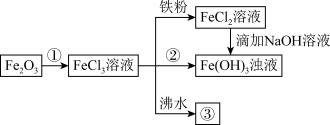
(1) 与物质①反应的离子方程式为
与物质①反应的离子方程式为______ 。
(2)铁粉与 溶液反应的离子方程式为
溶液反应的离子方程式为______ 。
(3)向 溶液中滴加NaOH溶液最终生成
溶液中滴加NaOH溶液最终生成 浊液,该过程的现象为
浊液,该过程的现象为______ 。此过程中, 转化为
转化为 的反应为
的反应为______ (用化学方程式表示)。
II.金属及其化合物在人类生活,生产中发挥着重要的作用。印刷电路板由高分子材料和铜箔复合而成,刻制印刷电路时,工业上常用溶液作为“腐蚀液”,有 和
和 生成。从使用过的腐蚀废液中回收铜并重新获得溶液的工艺流程如下,
生成。从使用过的腐蚀废液中回收铜并重新获得溶液的工艺流程如下,
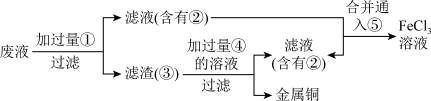
(4) 溶液与金属铜发生反应的离子方程式为
溶液与金属铜发生反应的离子方程式为______ 。
(5)流程图中物质①、②、④的化学式分别为______ 、______ 、______ 。
(6)含有物质②的滤液与气体⑤反应的化学方程式为______ 。
I.为认识铁及其化合物的性质和分散系的性质,化学兴趣小组的同学做了如下一组综合实验。

(1)
 与物质①反应的离子方程式为
与物质①反应的离子方程式为(2)铁粉与
 溶液反应的离子方程式为
溶液反应的离子方程式为(3)向
 溶液中滴加NaOH溶液最终生成
溶液中滴加NaOH溶液最终生成 浊液,该过程的现象为
浊液,该过程的现象为 转化为
转化为 的反应为
的反应为II.金属及其化合物在人类生活,生产中发挥着重要的作用。印刷电路板由高分子材料和铜箔复合而成,刻制印刷电路时,工业上常用溶液作为“腐蚀液”,有
 和
和 生成。从使用过的腐蚀废液中回收铜并重新获得溶液的工艺流程如下,
生成。从使用过的腐蚀废液中回收铜并重新获得溶液的工艺流程如下,
(4)
 溶液与金属铜发生反应的离子方程式为
溶液与金属铜发生反应的离子方程式为(5)流程图中物质①、②、④的化学式分别为
(6)含有物质②的滤液与气体⑤反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】氧化镁是优良的阻燃剂,同时在医药、建筑等行业的应用也十分广泛。用硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量SiO2、FeCO3等)为原料制备高纯氧化镁的实验流程如下:

已知在水溶液中生成氢氧化物沉淀的pH:
(1)菱镁矿酸溶前需要粉碎,目的是_______________ 。
(2)加入H2O2氧化时,发生反应的离子方程式为______________________ 。
(3)加氨水调节溶液的pH范围为________ ,滤渣2 的主要成分是____________ (填化学式)。
(4)流程图中在获得滤渣2的“过滤”与“煅烧”之间要经过的操作步骤为_______ 、过滤等操作,得到MgSO4·xH2O晶体。
(5)已知煅烧12.3gMgSO4·xH2O晶体得到2gMgO,则x值为_____________ 。

已知在水溶液中生成氢氧化物沉淀的pH:
| Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 9.4 | 7.6 | 1.5 |
| 完全沉淀时 | 10.4 | 9.7 | 2.8 |
(2)加入H2O2氧化时,发生反应的离子方程式为
(3)加氨水调节溶液的pH范围为
(4)流程图中在获得滤渣2的“过滤”与“煅烧”之间要经过的操作步骤为
(5)已知煅烧12.3gMgSO4·xH2O晶体得到2gMgO,则x值为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】我国具有丰富的锑矿资源,锑及其化合物被广泛应用于机械材料、塑料、阻燃剂、微电子技术等领域,具有十分重要的价值。利用脆硫铅锑精矿(主要成分是Sb2S3及PbS)制备锑白(Sb2O3)的工艺流程如图所示。
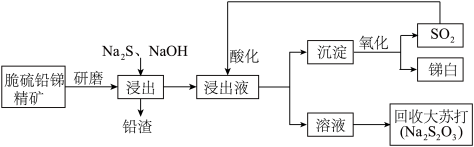
已知:浸出反应Sb2S3+3Na2S = 2Na3SbS3
酸化反应4Na3SbS3 +9SO2=6Na2S2O3+3S↓+2Sb2S3↓
回答下列问题。
(1)精矿进行研磨的目的是___________________ 。
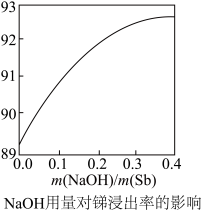
(2)在浸出反应中,浸出率随NaOH用量的变化曲线如图所示,其中NaOH的作用是_______________________ 。
(3)向浸出液中通入SO2气体进行酸化,得到Sb2S3中间体。酸化反应过程中,pH对锑沉淀率及酸化后溶液中Na2S2O3含量的影响如下表所示,则最适宜的pH为__________ 。 pH不能过低的原因是_______________ (结合离子方程式说明)。
(4)浸出液酸化后过滤,得到沉淀混合物,在高温下被氧化,写出所有反应的化学方程式:_____________ 。
(5)从尾气处理的角度评价该工艺流程在环保方面的优点是__________________ 。

已知:浸出反应Sb2S3+3Na2S = 2Na3SbS3
酸化反应4Na3SbS3 +9SO2=6Na2S2O3+3S↓+2Sb2S3↓
回答下列问题。
(1)精矿进行研磨的目的是
(2)在浸出反应中,浸出率随NaOH用量的变化曲线如图所示,其中NaOH的作用是

(3)向浸出液中通入SO2气体进行酸化,得到Sb2S3中间体。酸化反应过程中,pH对锑沉淀率及酸化后溶液中Na2S2O3含量的影响如下表所示,则最适宜的pH为
| pH | 酸化后溶液成分/(g·L-1) | 锑的沉淀率/% | |
| Sb | Na2S2O3 | ||
| 6 | 0.6 | 160.5 | 99.5 |
| 7 | 2.7 | 157.6 | 97.5 |
| 8 | 5.6 | 150.4 | 95.4 |
| 9 | 10.5 | 145.0 | 92.4 |
(4)浸出液酸化后过滤,得到沉淀混合物,在高温下被氧化,写出所有反应的化学方程式:
(5)从尾气处理的角度评价该工艺流程在环保方面的优点是
您最近一年使用:0次



