(1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______ (填实验编号); 若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为_______ 和_______ 。
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(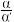 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
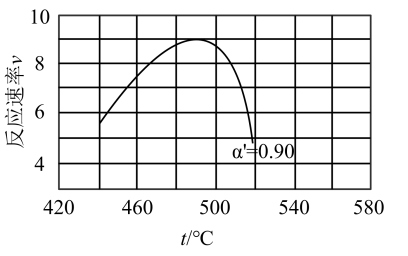
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是_______
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
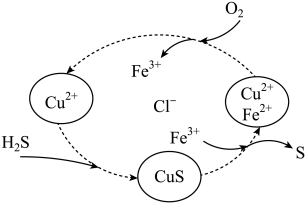
图2
①该循环过程中 Fe3+起的作用是:________ 写出该该反应的化学方程式_______
| 实验 编号 | 实验温 度/℃ | c(Na2S2O3) /(mol·L-1) | V(Na2S2O3) /mL | c(H2SO4) /(mol·L-1) | V(H2SO4) /mL | V(H2O) /mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
(2)研究表明,SO2催化氧化的反应速率方程为:v = k(
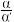 −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:

图2
①该循环过程中 Fe3+起的作用是:
更新时间:2021-01-20 22:58:18
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】硫酸铁铵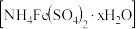 是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:
是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:

(1)步骤①中洗去废铁屑表面的油污,可以选用的试剂是_______ 。
A.热的稀硫酸 B.热水 C.热的碳酸钠溶液
(2)步骤②需要加热的目的是_______ 。
(3)步骤②温度保持80~95℃,采用的合适加热方式是_______ 。
(4)步骤③加入5% 的目的是
的目的是_______ ,请写出反应的离子方程式:_______ 。
(5)准确称取48.2g硫酸铁铵纯样品,加入足量的 溶液,充分反应后,过滤、洗涤、干燥、称量,得到46.6g沉淀,则
溶液,充分反应后,过滤、洗涤、干燥、称量,得到46.6g沉淀,则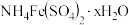 中x=
中x=_______ 。
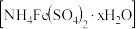 是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:
是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:
(1)步骤①中洗去废铁屑表面的油污,可以选用的试剂是
A.热的稀硫酸 B.热水 C.热的碳酸钠溶液
(2)步骤②需要加热的目的是
(3)步骤②温度保持80~95℃,采用的合适加热方式是
(4)步骤③加入5%
 的目的是
的目的是(5)准确称取48.2g硫酸铁铵纯样品,加入足量的
 溶液,充分反应后,过滤、洗涤、干燥、称量,得到46.6g沉淀,则
溶液,充分反应后,过滤、洗涤、干燥、称量,得到46.6g沉淀,则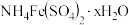 中x=
中x=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】汽车尾气中含有CO、NO等有害气体。
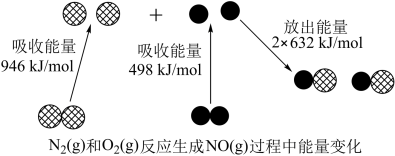
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________ (填“吸收”或“放出”)________ kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
①请将表中数据补充完整:a___________ 。
②能验证温度对化学反应速率规律的是实验____________________ (填实验序号)。
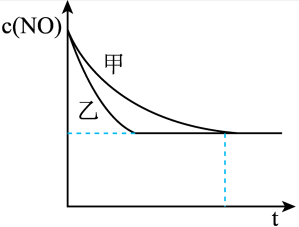
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________ (填“甲”或“乙”)。
④在容积固定的容器中发生反应2NO+2CO 2CO2+N2,不能说明已达到平衡状态的是
2CO2+N2,不能说明已达到平衡状态的是________ (不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会

(2)一种新型催化剂用于NO和CO的反应:2NO+2CO
 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。| 实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

④在容积固定的容器中发生反应2NO+2CO
 2CO2+N2,不能说明已达到平衡状态的是
2CO2+N2,不能说明已达到平衡状态的是A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
(1)甲同学实验报告中的实验步骤②为__________________________________ 。
(2)甲同学的实验目的是_______________________________ ;要得出正确的实验结论,还需控制的实验条件是__________________ 。
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________ 。
(4)乙同学不会选用___________ mol/L硫酸完成该实验,理由是_________________ 。
Ⅱ.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________ 。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________ 。
(3)在该实验过程中,需要观察和记录________________ ,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________ 。
Ⅰ.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的1.5mol/L的硫酸于两支试管中; ② | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为
(2)甲同学的实验目的是
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是
(4)乙同学不会选用
Ⅱ.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
| 实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
| ① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
| ② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
| ③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
| ④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有
(3)在该实验过程中,需要观察和记录
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,自然界氮的循环过程如图。
(1)农谚“一场雷雨一场肥”中属于自然固氮的化学方程式为_______ 。
(2)合成氨反应是重要的人工固氮方式,其中铁触媒是催化剂,反应机理如图所示_______ ,该过程原子利用率为_______ 。
②下列关于铁触媒催化剂的说法正确的是_______ (填字母)。
a.可以增大反应速率
b.可以降低合成氨反应的能耗
c.反应过程中,铁的化合价保持不变
d.催化剂的量越多。化学反应速率越快
(3)生活污水的直接排放,会使自然水域中的氨氮含量超标,折点氯化法是处理氨氮废水的常用方法,其原理是向废水中通入足量的氯气,利用氯水中的HClO将 转化为无害的气体,写出HClO和
转化为无害的气体,写出HClO和 反应的离子方程式:
反应的离子方程式:_______ ,该法的优点是反应速率快,脱氮效果好,缺点可能是_______ (答一条即可)。
(4)动物排泄物中含有尿素,化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素。既能产生净化的水,又能发电。尿素燃料电池结构如图所示。_______ 极,发生的反应类型为_______ ,甲电极上发生的电极方程式为_______ 。

(1)农谚“一场雷雨一场肥”中属于自然固氮的化学方程式为
(2)合成氨反应是重要的人工固氮方式,其中铁触媒是催化剂,反应机理如图所示

②下列关于铁触媒催化剂的说法正确的是
a.可以增大反应速率
b.可以降低合成氨反应的能耗
c.反应过程中,铁的化合价保持不变
d.催化剂的量越多。化学反应速率越快
(3)生活污水的直接排放,会使自然水域中的氨氮含量超标,折点氯化法是处理氨氮废水的常用方法,其原理是向废水中通入足量的氯气,利用氯水中的HClO将
 转化为无害的气体,写出HClO和
转化为无害的气体,写出HClO和 反应的离子方程式:
反应的离子方程式:(4)动物排泄物中含有尿素,化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素。既能产生净化的水,又能发电。尿素燃料电池结构如图所示。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。回答下列问题:
(1)室温下,过氧化氢的Ka1=2.24×10-12,则H2O2的酸性________ H2O(填“>”“<”或“=”),H2O2的一级电离方程式为________ 。
(2)研究表明,过氧化氢溶液中c(HO )越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是
)越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是________ 。

(3)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见表:
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是________ ;储运过氧化氢时,可选用的容器材质为________ (填序号)。
A.不锈钢 B.黄铜 C.纯铝 D.铸铁
(1)室温下,过氧化氢的Ka1=2.24×10-12,则H2O2的酸性
(2)研究表明,过氧化氢溶液中c(HO
 )越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是
)越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是
(3)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见表:
| 离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% |
| 无 | — | 2 | Fe3+ | 1.0 | 15 |
| Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
| Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是
A.不锈钢 B.黄铜 C.纯铝 D.铸铁
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
[实验内容]
请回答:
(1)请写出H2C2O4溶液和酸性KMnO4溶液反应的离子反应方程式_______ 。
(2)实验过程使用了“控制变量法”,则V1=_______ ,V2=_______ ;根据上表中的实验数据,可以得到的结论是_______ 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但乙同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。

该小组同学根据如图所示信息提出了新的假设,并继续进行实验探究:
①该小组同学提出的假设是_______ 。
②请你帮助该小组同学完成实验方案。
再向试管中加入的少量固体的化学式为_______ 。
③若该小组同学提出的假设成立,应观察到的现象是_______ 。
[实验内容]
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol·L-1H2C2O4溶液 | H2O | 0.2molL-1KMnO4溶液 | 3mol·L-1稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | V1 | 4.0 |
| 2 | 2.0 | V2 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
(1)请写出H2C2O4溶液和酸性KMnO4溶液反应的离子反应方程式
(2)实验过程使用了“控制变量法”,则V1=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但乙同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。

该小组同学根据如图所示信息提出了新的假设,并继续进行实验探究:
①该小组同学提出的假设是
②请你帮助该小组同学完成实验方案。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol·L-1H2C2O4溶液 | H2O | 0.2mol·L-1KMnO4溶液 | 3mol·L-1稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | _______ | t |
③若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次



