(1)3.01×1023个OH-的物质的量为_______ ,含有电子的物质的量为_______ ,这些OH-和_______ g的Na+含有的电子数相同。
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c( )=
)=_______ 。
(3)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请将上述化学方程式改写为离子方程式_______ 。
②浓盐酸在反应中显示出来的性质是_______ (填字母)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③此反应中氧化产物是_______ (填化学式),还原性Cl-______ Mn2+(填>、<或=)。
④用双线桥法表示该反应电子转移的方向和数目:_______ 。
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、
 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c( )=
)=(3)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请将上述化学方程式改写为离子方程式
②浓盐酸在反应中显示出来的性质是
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③此反应中氧化产物是
④用双线桥法表示该反应电子转移的方向和数目:
更新时间:2021-03-11 13:10:58
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.
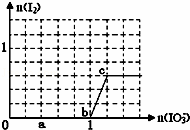
(1)a点时消耗NaHSO3的物质的量为_____ mol,假设反应中无SO2逸出。
(2)从b点开始计算,当生成0.3mol I2时,转移电子数为_______ 个。

(1)a点时消耗NaHSO3的物质的量为
(2)从b点开始计算,当生成0.3mol I2时,转移电子数为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】(1)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为____________ 。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为____________ mol。
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是___________ mL。
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为_______________________________ ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______________ 。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为
您最近一年使用:0次
【推荐3】回答下列问题:
(1)一定条件下,由稳定单质反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。图为VIA族元素氢化物a、b、c、d的生成热数据示意图。

①非金属元素氢化物的稳定性与氢化物的生成热△H的关系为_______ 。
②硫化氢发生分解反应的热化学方程式为_______ 。
(2)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1
b)CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
c)CH4(g) C(s)+2H2(g) △H3
C(s)+2H2(g) △H3
d)2CO(g) CO2(g)+C(s) △H4
CO2(g)+C(s) △H4
e)CO(g)+H2(g) H2O(g)+C(s) △H5
H2O(g)+C(s) △H5
根据盖斯定律,反应a的△H1=_______ (写出一个代数式即可)
(3)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25°C时,相关物质的燃烧热数据如表:
则25°C时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为_______ 。
(4)已知5C2H4(g)+12MnO (aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为_______ (用含m、n的代数式表示)
(1)一定条件下,由稳定单质反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。图为VIA族元素氢化物a、b、c、d的生成热数据示意图。

①非金属元素氢化物的稳定性与氢化物的生成热△H的关系为
②硫化氢发生分解反应的热化学方程式为
(2)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2c)CH4(g)
 C(s)+2H2(g) △H3
C(s)+2H2(g) △H3d)2CO(g)
 CO2(g)+C(s) △H4
CO2(g)+C(s) △H4e)CO(g)+H2(g)
 H2O(g)+C(s) △H5
H2O(g)+C(s) △H5根据盖斯定律,反应a的△H1=
(3)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25°C时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热△H(kJ·mol-1) | -285.8 | -393.5 | -3267.5 |
(4)已知5C2H4(g)+12MnO
 (aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】用氢气还原某二价金属氧化物,使金属元素成为单质,每4.0 g金属氧化物被还原时,需耗用0.10 g氢气,则该金属的相对原子质量是_________ ?写出该金属元素的名称为_______ 。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl—KCl+Cl2↑+H2O。
(1)配平上述反应化学方程式:
____ KClO3+_____ HCl——___ KCl+_____ Cl2↑+______ H2O
(2)若产生0.1mol Cl2,则转移电子的物质的量为_______ mol。
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐酸的物质的量浓度________ 。
(1)配平上述反应化学方程式:
(2)若产生0.1mol Cl2,则转移电子的物质的量为
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐酸的物质的量浓度
您最近一年使用:0次



