能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题。回答下列问题:
(1)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式____ 。
(2)在C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ·mol-1(b>0)的反应中,反应物具有的总能量____ (填“大于”“等于”或“小于”)生成物具有的总能量,那么在发生该反应时,反应物就需要_____ (填“放出”或“吸收”)能量才能转化为生成物。
(3)关于用水制取二次能源氢气,以下研究方向不正确的是_______ (填序号)。
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳
的排放。有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1
②CH3OH(g)=CH3OH(l) ΔH=-b kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH=-c kJ·mol-1
④H2O(g)=H2O(l) ΔH=-d kJ·mol-1
则表示CH3OH(l) 燃烧热的热化学方程式为____ 。
(5)化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应之一如下:
CO与H2反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
提示:甲醇的电子式: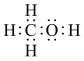 、结构式:
、结构式: 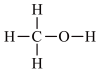
若生成1mol CH3OH放出 a kJ的能量,反应中拆开1mol化学键所需的能量(E)的相关数据如下:
根据相关数据计算拆开1molC O所需的能量E1=
O所需的能量E1=____ kJ。
(1)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式
(2)在C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ·mol-1(b>0)的反应中,反应物具有的总能量
(3)关于用水制取二次能源氢气,以下研究方向不正确的是
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳
的排放。有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1
②CH3OH(g)=CH3OH(l) ΔH=-b kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH=-c kJ·mol-1
④H2O(g)=H2O(l) ΔH=-d kJ·mol-1
则表示CH3OH(l) 燃烧热的热化学方程式为
(5)化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应之一如下:
CO与H2反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
提示:甲醇的电子式:
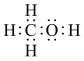 、结构式:
、结构式: 
若生成1mol CH3OH放出 a kJ的能量,反应中拆开1mol化学键所需的能量(E)的相关数据如下:
| 化学键 | H—H | C—O | CO中的 C O O | H—O | C—H |
| E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC
 O所需的能量E1=
O所需的能量E1=
更新时间:2021-04-09 23:10:15
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】镁化合物具有广泛用途。请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的____ ,还生成少量的______ (填化学式);
(2)CH3MgCl是一种重要的有机合成试剂,其中镁的化合价是___________ ,该化合物水解的化学方程式为____________ ;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
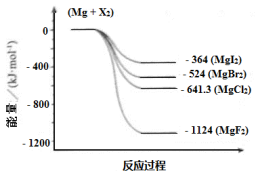
下列选项中正确的是_____________ (填序号)。
① MgI2中Mg2+ 与I- 间的作用力小于MgF2中Mg2+ 与F- 间的作用力
② Mg与F2的反应是吸热反应
③ MgBr2与Cl2 反应的△H > 0
④ 化合物的热稳定性顺序为MgI2 < MgBr2 < MgCl2 < MgF2
⑤ MgF2(s) + Br2(l) = MgBr2(s) + F2(g) △H = +600 kJ · mol-1
(1)单质镁在空气中燃烧的主要产物是白色的
(2)CH3MgCl是一种重要的有机合成试剂,其中镁的化合价是
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

下列选项中正确的是
① MgI2中Mg2+ 与I- 间的作用力小于MgF2中Mg2+ 与F- 间的作用力
② Mg与F2的反应是吸热反应
③ MgBr2与Cl2 反应的△H > 0
④ 化合物的热稳定性顺序为MgI2 < MgBr2 < MgCl2 < MgF2
⑤ MgF2(s) + Br2(l) = MgBr2(s) + F2(g) △H = +600 kJ · mol-1
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知:①2H2(g)+O2(g) =2H2O(l),ΔH1=-572 kJ·mol-1
②2H2O2(l) = 2H2O(l)+O2(g),ΔH2=-196 kJ·mol-1
1.请写出生产H2O2总反应的热化学方程式___________ 。
2.反应①中的ΔH1___________ (选填: A.是 B.否)为H2的燃烧热,原因为___________ 。
3.H2O2沸点为150.2℃,受热容易分解。某试剂厂欲将7%的过氧化氢溶液浓缩成30%的溶液,以下方法中可以采用的是___________。
②2H2O2(l) = 2H2O(l)+O2(g),ΔH2=-196 kJ·mol-1
1.请写出生产H2O2总反应的热化学方程式
2.反应①中的ΔH1
3.H2O2沸点为150.2℃,受热容易分解。某试剂厂欲将7%的过氧化氢溶液浓缩成30%的溶液,以下方法中可以采用的是___________。
| A.常压蒸馏 | B.减压蒸馏 | C.加热蒸发 | D.加氧化钙除水 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)键能是表征化学键强度的物理量,可以用键断裂时所需能量的大小来衡量。从断键和成键的角度分析反应2H2(g)+O2(g)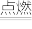 2H2O(g)中能量的变化,化学键的键能如表所示:
2H2O(g)中能量的变化,化学键的键能如表所示:
则生成1molH2O(g)可以放出____ kJ热量。
(2)下列反应中,属于放热反应的是____ (填字母,下同),属于吸热反应的是____ 。
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.葡萄糖在人体内氧化分解
(3)A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向____ (填“A”或“B”)极。
②装置乙中正极的电极反应式为____ 。
③四种金属活动性由强到弱的顺序是____ 。
(1)键能是表征化学键强度的物理量,可以用键断裂时所需能量的大小来衡量。从断键和成键的角度分析反应2H2(g)+O2(g)
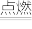 2H2O(g)中能量的变化,化学键的键能如表所示:
2H2O(g)中能量的变化,化学键的键能如表所示:| 化学键 | H—H | O=O | H—O |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
则生成1molH2O(g)可以放出
(2)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.葡萄糖在人体内氧化分解
(3)A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 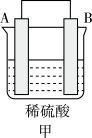 |  | 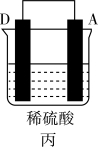 |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向
②装置乙中正极的电极反应式为
③四种金属活动性由强到弱的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列填空:
(1)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5 kJ热量,其热化学方程式为:___________ ;
(2)已知H-H键键能为436 kJ/mol,H-N键键能为391 kJ/mol,根据化学方程式:N2(g)+3H2(g) 2NH3(g)
2NH3(g)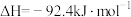 ,则N≡N键键能是
,则N≡N键键能是___________ ;
(3)1 mol氧气与足量氢气反应生成水蒸气放热483.6 kJ,若1 mol水蒸气转化成液态水放热44 kJ,写出表示氢气燃烧热的热化学方程式:___________ ;
(4)下列反应中,属于放热反应的是___________ ,属于吸热反应的是___________ ;
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
(5)已知:①
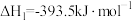
②
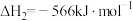
③
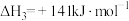
则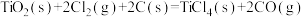 的
的 =
= ___________ 。
(1)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5 kJ热量,其热化学方程式为:
(2)已知H-H键键能为436 kJ/mol,H-N键键能为391 kJ/mol,根据化学方程式:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)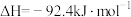 ,则N≡N键键能是
,则N≡N键键能是(3)1 mol氧气与足量氢气反应生成水蒸气放热483.6 kJ,若1 mol水蒸气转化成液态水放热44 kJ,写出表示氢气燃烧热的热化学方程式:
(4)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
(5)已知:①

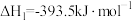
②

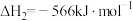
③

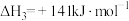
则
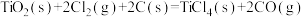 的
的 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
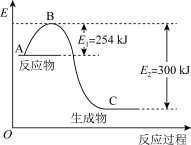
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请问该化学反应属于___________ (放热或吸热)反应,请写出该反应的热化学方程式:___________ 。
(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8kJ·mol-1,又已知1molH2O(l)转化成1molH2O(g)吸收44kJ的热量,___________ molH2完全燃烧生成气态水可以放出120.9kJ的热量(不考虑热量损失)。
(3)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1=+108.0kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.0kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH3=___________ kJ·mol-1
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请问该化学反应属于

(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8kJ·mol-1,又已知1molH2O(l)转化成1molH2O(g)吸收44kJ的热量,
(3)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1=+108.0kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.0kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH3=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________ 。
(2)氨是制备氮肥、硝酸等的重要原料②③
①已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________ 。
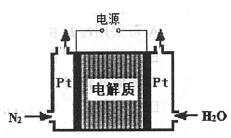
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________ 。
(3)反应:2NO(g)+O2(g) 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________ 。
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g) N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________ 。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________ 。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式
(2)氨是制备氮肥、硝酸等的重要原料②③
①已知:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/molN2(g)+O2(g)
 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol2H2(g)+O2(g)
 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol试写出表示氨的标准燃烧热的热化学方程式
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式
(3)反应:2NO(g)+O2(g)
 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:
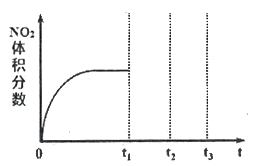
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g)
 N2O2(g) △H<0
N2O2(g) △H<0II N2O2(g)+O2(g)
 2NO2(g) △H<0
2NO2(g) △H<0已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知甲和乙在溶液中的转化关系如图所示:

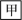 。请回答下列问题:
。请回答下列问题:
(1)若甲是10电子的阳离子,乙是碱性气体。1 mol乙通入足量强酸溶液中与H+反应,反应过程中的能量变化如图。写出乙的一种用途________________ 。该反应的热化学方程式为___________________________ 。

(2)若甲是CO2,用CO2和NH3反应可以合成尿素,合成尿素的反应分为如下两步。
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1
第二步:H2NCOONH4(l)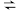 H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
在一体积为0.5 L的密闭容器中投入4 mol氨和1 mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如图Ⅰ所示。

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________ 步反应决定。
②反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则前10 min用CO2表示的第一步反应的速率为________ 。
③第二步反应的平衡常数K随温度的变化如图Ⅱ所示,则ΔH2________ 0(填“>”、“<”或“=”)。
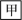
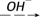

 。请回答下列问题:
。请回答下列问题:(1)若甲是10电子的阳离子,乙是碱性气体。1 mol乙通入足量强酸溶液中与H+反应,反应过程中的能量变化如图。写出乙的一种用途

(2)若甲是CO2,用CO2和NH3反应可以合成尿素,合成尿素的反应分为如下两步。
第一步:2NH3(l)+CO2(g)
 H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1第二步:H2NCOONH4(l)
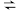 H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2在一体积为0.5 L的密闭容器中投入4 mol氨和1 mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如图Ⅰ所示。

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
②反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则前10 min用CO2表示的第一步反应的速率为
③第二步反应的平衡常数K随温度的变化如图Ⅱ所示,则ΔH2
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】Ⅰ.联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为____________________ ,其中氮的化合价为________ 。
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________________ 。
(3)①2O2(g)+N2(g)===N2O4(l) ΔH1
②N2(g)+2H2(g)===N2H4(l) ΔH2
③O2(g)+2H2(g)===2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1048.9 kJ·mol-1
上述反应热效应之间的关系式为ΔH4=____________ ,联氨和N2O4可作为火箭推进剂的主要原因为__________________________________ 。
Ⅱ.煤燃烧排放的烟气含SO2和NO2,形成酸雨,污染大气。现用NaClO、Ca(ClO)2处理,得到较好的烟气脱硫效果。
(4)已知下列反应:
SO2(g)+2OH-(aq)===SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)===SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=________ 。
Ⅲ.(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25 ℃,101 kPa时:
CaO(s)+H2SO4(l)===CaSO4(s)+H2O(l)'ΔH=-271 kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)===Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是__________________ 。
Ⅳ.(6)氢气可用于制备H2O2。已知:
H2(g)+A(l)===B(l) ΔH1
O2(g)+B(l)===A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)===H2O2(l)的ΔH________ 0(填“>”“<”或“=”)。
(1)联氨分子的电子式为
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为
(3)①2O2(g)+N2(g)===N2O4(l) ΔH1
②N2(g)+2H2(g)===N2H4(l) ΔH2
③O2(g)+2H2(g)===2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1048.9 kJ·mol-1
上述反应热效应之间的关系式为ΔH4=
Ⅱ.煤燃烧排放的烟气含SO2和NO2,形成酸雨,污染大气。现用NaClO、Ca(ClO)2处理,得到较好的烟气脱硫效果。
(4)已知下列反应:
SO2(g)+2OH-(aq)===SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)===SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
Ⅲ.(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25 ℃,101 kPa时:
CaO(s)+H2SO4(l)===CaSO4(s)+H2O(l)'ΔH=-271 kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)===Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是
Ⅳ.(6)氢气可用于制备H2O2。已知:
H2(g)+A(l)===B(l) ΔH1
O2(g)+B(l)===A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)===H2O2(l)的ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________ 、_______ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:
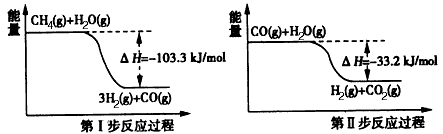
甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________ 。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________ 。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次



