Ⅰ.(1)下列变化中,属于吸热反应的是_______ 。
①液态水汽化 ②Ba(OH)2•8H2O与固体NH4Cl混合 ③浓H2SO4稀释 ④高锰酸钾分解制O2 ⑤生石灰跟水反应生成熟石灰 ⑥将胆矾加热变为白色粉末 ⑦CO2+C 2CO ⑧CaCO3高温分解 ⑨N2+3H2
2CO ⑧CaCO3高温分解 ⑨N2+3H2  2NH3 ⑩C+H2O(g)
2NH3 ⑩C+H2O(g) CO+H2
CO+H2
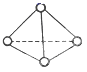
(2)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为N2时要_______ 填“吸收”或“放出”)热量_______ kJ。
Ⅱ.原电池是化学对人类的一项重大贡献。
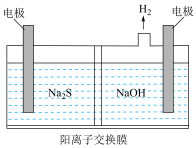
(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。
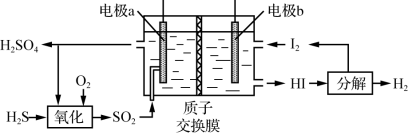
电极a上发生反应的电极反应式为_______ 。
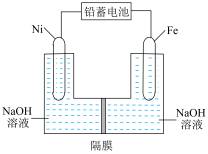
(4)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为_______ 。
(5)一次电池碱性锌锰电池在生活中用途广泛,已知该电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出该电池正极电极反应式_______ 。
(6)甲醇(CH3OH)是一种重要的化工原料和新型燃料。写出用氢氧化钾溶液作电解质时该甲醇燃料电池的负极电极反应式:_______ 。
①液态水汽化 ②Ba(OH)2•8H2O与固体NH4Cl混合 ③浓H2SO4稀释 ④高锰酸钾分解制O2 ⑤生石灰跟水反应生成熟石灰 ⑥将胆矾加热变为白色粉末 ⑦CO2+C
 2CO ⑧CaCO3高温分解 ⑨N2+3H2
2CO ⑧CaCO3高温分解 ⑨N2+3H2  2NH3 ⑩C+H2O(g)
2NH3 ⑩C+H2O(g) CO+H2
CO+H2(2)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为N2时要

Ⅱ.原电池是化学对人类的一项重大贡献。
(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。

电极a上发生反应的电极反应式为
(4)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为
(5)一次电池碱性锌锰电池在生活中用途广泛,已知该电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出该电池正极电极反应式
(6)甲醇(CH3OH)是一种重要的化工原料和新型燃料。写出用氢氧化钾溶液作电解质时该甲醇燃料电池的负极电极反应式:
更新时间:2021-04-16 11:31:59
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】化学反应是人类获取能量的重要途径,我们可以通过化学反应实现化学能向热能、电能的直接转化。
Ⅰ.回答下列问题:
(1)从能量变化角度研究反应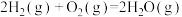 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是___________ (填字母)。
A.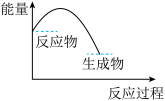 B.
B.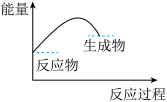
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
则常温常压下,1mol  在空气中充分燃烧,生成1mol
在空气中充分燃烧,生成1mol  (g)放出热量
(g)放出热量___________ kJ。
Ⅱ.各类电池广泛用在交通工具(如电动汽车、电动自行车等)上,实现了节能减排,也为生活带来了极大的便利。
(3)传统汽车中使用的电池主要是铅蓄电池,其构造如图所示。

①电池工作时,电子由___________ 流出(填“Pb”或“ ”)。
”)。
②该电池的工作原理为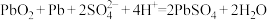 ,其工作时电解质溶液的pH将
,其工作时电解质溶液的pH将___________ (填“增大”“减小”或“不变”)。
(4)2020年上海进博会展览中,诸多氢能源汽车纷纷亮相,氢氧燃料电池被誉为氢能源汽车的心脏。某种氢氧燃料电池的内部结构如图所示:
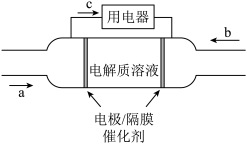
①a处通入的气体是___________ ;
②电池每消耗标准状况下5.6L氢气,电路中通过的电子数目为___________ 。
Ⅲ.为了更好地利用化学反应中物质和能量的变化,在化学研究和工业生产中还需要关注化学反应的快慢和限度。能量、速率与限度是认识和研究化学反应的重要因素。某温度下,向2.0L的恒容密闭容器中充入2.0mol 和2.0mol
和2.0mol ,发生反应,实验数据如下表所示:
,发生反应,实验数据如下表所示:
(5)0~50s内的平均反应速率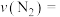
___________ 。
(6)为加快反应速率,可采取的措施是___________ (填字母)。
a.升高温度 b.增大容器体积 c.加入合适的催化剂
(7)上述反应中,氢气的平衡转化率为___________ 。
Ⅰ.回答下列问题:
(1)从能量变化角度研究反应
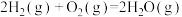 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是A.
 B.
B.
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
| 化学键 | H—H | 0=0 | H—O |
| 键能(kJ/mol) | 436 | 496 | 463 |
 在空气中充分燃烧,生成1mol
在空气中充分燃烧,生成1mol  (g)放出热量
(g)放出热量Ⅱ.各类电池广泛用在交通工具(如电动汽车、电动自行车等)上,实现了节能减排,也为生活带来了极大的便利。
(3)传统汽车中使用的电池主要是铅蓄电池,其构造如图所示。

①电池工作时,电子由
 ”)。
”)。②该电池的工作原理为
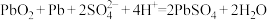 ,其工作时电解质溶液的pH将
,其工作时电解质溶液的pH将(4)2020年上海进博会展览中,诸多氢能源汽车纷纷亮相,氢氧燃料电池被誉为氢能源汽车的心脏。某种氢氧燃料电池的内部结构如图所示:

①a处通入的气体是
②电池每消耗标准状况下5.6L氢气,电路中通过的电子数目为
Ⅲ.为了更好地利用化学反应中物质和能量的变化,在化学研究和工业生产中还需要关注化学反应的快慢和限度。能量、速率与限度是认识和研究化学反应的重要因素。某温度下,向2.0L的恒容密闭容器中充入2.0mol
 和2.0mol
和2.0mol ,发生反应,实验数据如下表所示:
,发生反应,实验数据如下表所示:| t/s | 0 | 50 | 150 | 250 | 350 |
 /mol /mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(6)为加快反应速率,可采取的措施是
a.升高温度 b.增大容器体积 c.加入合适的催化剂
(7)上述反应中,氢气的平衡转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应。
a.镁与盐酸反应;b.氢氧化钠与盐酸反应;c.盐酸与碳酸氢钠反应;d.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
(1)反应d的化学方程式是___________ 。
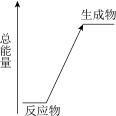
(2)以上化学反应中能用下图表示其能量变化的是___________ (填字母),此类反应中有能量变化的原因是:断开反应物的化学键吸收的总能量___________ (填“>”或“<”)形成生成物的化学键释放的总能量。
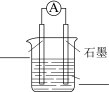
①将下图原电池装置补充完整。___________ ___________ 。
③正极的电极反应式是___________ 。
a.镁与盐酸反应;b.氢氧化钠与盐酸反应;c.盐酸与碳酸氢钠反应;d.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
(1)反应d的化学方程式是
(2)以上化学反应中能用下图表示其能量变化的是
①将下图原电池装置补充完整。
③正极的电极反应式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】道路千万条,安全第一条,行车不规范,亲人两行泪。减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内一般充入的是叠氮化钠(NaN3)、硝酸铵(NH4NO3)、硝酸钾(KNO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解或发生反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______ 。
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
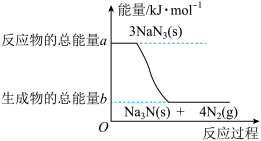
①叠氮化钠的爆炸反应属于_______ (填“吸热”或“放热”)反应。
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学键),则反应的能量变化为____ kJ(用含a、b的代数式表示),消耗叠氮化钠的质量为_________ g。
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是________ mol,同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是___________________ 。
请回答下列问题:
(1)下列判断正确的是
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:

①叠氮化钠的爆炸反应属于
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学键),则反应的能量变化为
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)通过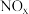 传感器可监测
传感器可监测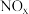 的含量,其工作原理示意图如下:
的含量,其工作原理示意图如下:
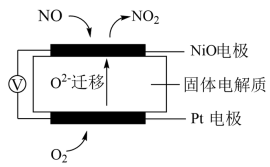
① 电极上发生的是
电极上发生的是_______ 反应(填“氧化”或“还原”)电极反应式_______ 。
②写出 电极的电极反应式:
电极的电极反应式:_______ 。
(2)用零价铁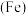 去除水体中的硝酸盐
去除水体中的硝酸盐 已成为环境修复研究的热点之一。
已成为环境修复研究的热点之一。 还原水体中
还原水体中 的反应原理如图所示。
的反应原理如图所示。
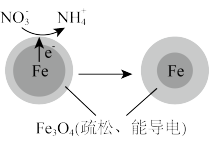
①作负极的物质是_______ 。
②正极的电极反应式是_______ 。
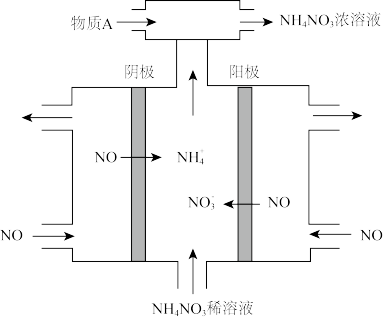
(3)电解 制备
制备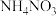 ,其工作原理如图所示,为使电解产物全部转化为
,其工作原理如图所示,为使电解产物全部转化为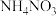 ,需补充物质A,A是
,需补充物质A,A是_______ ,说明理由:_______ 。
(1)通过
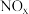 传感器可监测
传感器可监测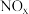 的含量,其工作原理示意图如下:
的含量,其工作原理示意图如下:
①
 电极上发生的是
电极上发生的是②写出
 电极的电极反应式:
电极的电极反应式:(2)用零价铁
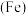 去除水体中的硝酸盐
去除水体中的硝酸盐 已成为环境修复研究的热点之一。
已成为环境修复研究的热点之一。 还原水体中
还原水体中 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质是
②正极的电极反应式是
(3)电解
 制备
制备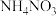 ,其工作原理如图所示,为使电解产物全部转化为
,其工作原理如图所示,为使电解产物全部转化为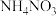 ,需补充物质A,A是
,需补充物质A,A是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某课外小组利用原电池原理驱动某简易小车(用电动机表示)。
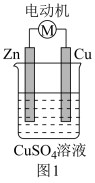
(1)初步设计的实验装置示意图如图1所示,CuSO4溶液在图1所示装置中的作用是_______ (答出一点即可)。
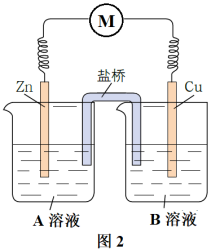
(2)实验发现:该装置不能驱动小车。该小组同学提出假设:可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是_______ 和_______ ,盐桥属于_______ (填“电子导体”或“离子导体”),盐桥中的Cl-移向_______ 溶液(填“A”或“B”)。
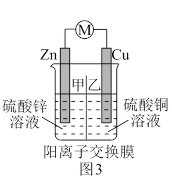
(3)丹尼尔电池是将Zn置于硫酸锌溶液中,将Cu置于硫酸铜溶液中,并离子交换膜等方法将两电解质溶液连接的一种原电池。图3是该电池的工作原理示意图。不考虑溶液体积的变化,下列叙述正确的是_______。
(1)初步设计的实验装置示意图如图1所示,CuSO4溶液在图1所示装置中的作用是

(2)实验发现:该装置不能驱动小车。该小组同学提出假设:可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是

(3)丹尼尔电池是将Zn置于硫酸锌溶液中,将Cu置于硫酸铜溶液中,并离子交换膜等方法将两电解质溶液连接的一种原电池。图3是该电池的工作原理示意图。不考虑溶液体积的变化,下列叙述正确的是_______。

| A.阴、阳离子分别通过离子交换膜向两极移动,保持溶液中的电荷平衡 |
| B.电子由锌电极经导线流向铜电极后,经溶液回到锌电极、形成闭合回路 |
C.电池工作一段时间后,甲、乙池中SO 的浓度均不变 的浓度均不变 |
| D.电池工作一段时间后,甲池溶液的总质量减小,乙池溶液的总质量增加 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】请根据所学知识,回答下列问题:
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
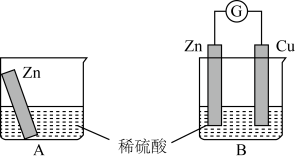
(1)B中Zn板是___________ 极,正极发生的电极反应是___________
(2)该小组同学反思原电池的原理,其中观点正确的是___________;
(3)在B中,当导线中有1 mol电子通过时,理论上的两极变化是___________。
(4)若将反应2Fe3++Cu=Cu2++2Fe2+设计成原电池,写出正极电极反应式___________ ;
(5)写出碱性氢氧燃料电池正极电极反应式___________
(6)写出酸性乙醇(C2H5OH)燃料电池负极电极反应式___________
(7)写出铜片和铝片插入浓硝酸溶液中的正极反应为:___________
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
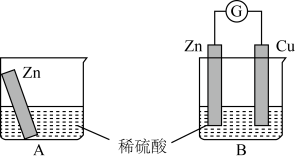
(1)B中Zn板是
(2)该小组同学反思原电池的原理,其中观点正确的是___________;
| A.原电池反应的过程中一定有电子转移 |
| B.电极一定不能参加反应 |
| C.原电池装置中的电子流向:负极→外线路→正极→电解质→负极 |
| D.氧化反应和还原反应可以拆开在两极发生 |
| A.锌片溶解32.5 g | B.锌片增重32.5 g |
| C.铜片上析出2 g H2 | D.铜片上析出1 mol H2 |
(5)写出碱性氢氧燃料电池正极电极反应式
(6)写出酸性乙醇(C2H5OH)燃料电池负极电极反应式
(7)写出铜片和铝片插入浓硝酸溶液中的正极反应为:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取____ gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式__ 。
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:阳极___ ,阴极____ 。
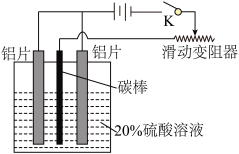
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式_______ 。
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:阳极

(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】铅蓄电池在日常生活中应用广泛。回答下列问题:
(1)现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移 电子时铁电极的质量减少
电子时铁电极的质量减少 ,则:
,则:
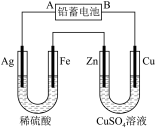
①A是铅蓄电池的___________ 极。
②Cu电极的电极反应式是___________ , 溶液的浓度
溶液的浓度___________ (填“减小”“增大”或“不变”)。
(2)铅蓄电池的 可以用石墨为电极,
可以用石墨为电极, 和
和 的混合溶液为电解液制取。阳极发生的电极反应式为
的混合溶液为电解液制取。阳极发生的电极反应式为___________ 。
(3)将 溶液加入如图所示的电解池的阳极区,用铅蓄电池进行电解,电解过程中阳极区发生如下反应:
溶液加入如图所示的电解池的阳极区,用铅蓄电池进行电解,电解过程中阳极区发生如下反应: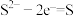 ,
, 。
。
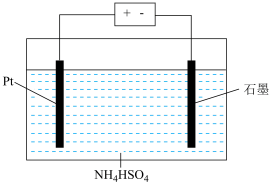
电解时阴极的电极反应式:___________ ,电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成___________ 。
(4) 是一种既能杀菌、消毒,又能䋈凝净水的水处理剂,其电解制法如图所示,请根据图示写出
是一种既能杀菌、消毒,又能䋈凝净水的水处理剂,其电解制法如图所示,请根据图示写出 电极发生的电极反应为:
电极发生的电极反应为:___________ 。
(5)工业上常采用催化还原法和碱吸收法处理 气体。当吸收液失去吸收能力后通入
气体。当吸收液失去吸收能力后通入 可得到
可得到 溶液,用如图所示装置电解所得
溶液,用如图所示装置电解所得 溶液可制得强氧化剂
溶液可制得强氧化剂 。
。
请写出电解 溶液的化学方程式
溶液的化学方程式___________ 。
(1)现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移
 电子时铁电极的质量减少
电子时铁电极的质量减少 ,则:
,则:
①A是铅蓄电池的
②Cu电极的电极反应式是
 溶液的浓度
溶液的浓度(2)铅蓄电池的
 可以用石墨为电极,
可以用石墨为电极, 和
和 的混合溶液为电解液制取。阳极发生的电极反应式为
的混合溶液为电解液制取。阳极发生的电极反应式为(3)将
 溶液加入如图所示的电解池的阳极区,用铅蓄电池进行电解,电解过程中阳极区发生如下反应:
溶液加入如图所示的电解池的阳极区,用铅蓄电池进行电解,电解过程中阳极区发生如下反应: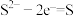 ,
, 。
。
电解时阴极的电极反应式:
(4)
 是一种既能杀菌、消毒,又能䋈凝净水的水处理剂,其电解制法如图所示,请根据图示写出
是一种既能杀菌、消毒,又能䋈凝净水的水处理剂,其电解制法如图所示,请根据图示写出 电极发生的电极反应为:
电极发生的电极反应为:
(5)工业上常采用催化还原法和碱吸收法处理
 气体。当吸收液失去吸收能力后通入
气体。当吸收液失去吸收能力后通入 可得到
可得到 溶液,用如图所示装置电解所得
溶液,用如图所示装置电解所得 溶液可制得强氧化剂
溶液可制得强氧化剂 。
。
请写出电解
 溶液的化学方程式
溶液的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】铅蓄电池
(1)电极材料及原料:正极:PbO2;负极:Pb
电解质溶液:H2SO4溶液
(2)电极反应式:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
放电过程(溶液密度减少):
负极(Pb):___________
正极(PbO2):___________
放电时负、正极反应式与充电时阴极、阳极反应式刚好相反,重新生成原电极材料Pb、PbO2。
充电过程(溶液密度增大):
阴极:___________
阳极:___________
(1)电极材料及原料:正极:PbO2;负极:Pb
电解质溶液:H2SO4溶液
(2)电极反应式:Pb(s)+PbO2(s)+2H2SO4(aq)
 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)放电过程(溶液密度减少):
负极(Pb):
正极(PbO2):
放电时负、正极反应式与充电时阴极、阳极反应式刚好相反,重新生成原电极材料Pb、PbO2。
充电过程(溶液密度增大):
阴极:
阳极:
您最近一年使用:0次



