葡萄糖酸钙是一种常用的药物,临床上用于治疗骨质疏松症。某实验室对葡萄糖酸钙的制备工艺进行研究,先以葡萄糖[CH2OH(CHOH)4CHO]和H2O2为原料制备葡萄糖酸[CH2OH(CHOH)4COOH],再用葡萄糖酸与碳酸钙反应制备葡萄糖酸钙。已知:30%H2O2溶液的密度为1.1g·cm-3,回答下列问题:
I.制备葡萄糖酸(装置如图所示)。
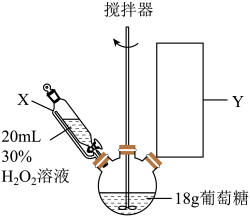
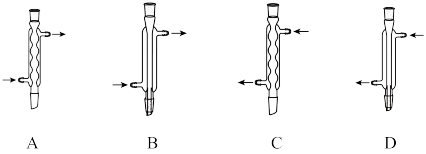
(1)仪器X的名称为___________ ,Y处为冷凝回流装置,下列仪器使用正确且效果最好的是___________ (填字母)。
(2)滴入双氧水,水浴加热一段时间后,得到无色透明的葡萄糖酸溶液。反应的化学方程式为___________ 。
Ⅱ.测定葡萄糖的转化率,确定合适的反应温度。
(3)用移液管取出三口烧瓶中的反应液2.00mL置于锥形瓶中,以酚酞作为指示剂并加20mL蒸馏水稀释,用0.04mol·L-1NaOH标准溶液滴定。
①滴定管使用的正确的操作顺序为蒸馏水洗涤→标准液润洗→___________ →___________ →___________ →___________ →洗净→放回滴定管架(填字母)。
a.滴定结束后,记录刻度
b.调节液面至0刻度或0刻度略靠下,记录刻度
c.装入标准液并排净尖嘴处的气泡
d.将未滴定完的标准液回收
②达到滴定终点时的现象为___________ 。
③滴定过程消耗NaOH标准溶液的体积为V0mL,反应后三口烧瓶内溶液的体积为V1mL,实验条件下葡萄糖的转化率为___________ (用含V0和V1的代数式表示)。
④若滴定终点时俯视读数,对转化率的影响为___________ (填“偏高”“偏低”或“无影响”)。
Ⅲ.制备葡萄糖酸钙。
将CaCO3分散于适量蒸馏水中形成浊液,加入葡萄糖酸,至无CO2气体放出为止,煮沸,并趁热采用下图装置抽滤,滤掉未反应的CaCO3,得到澄清透明的葡萄糖酸钙溶液。
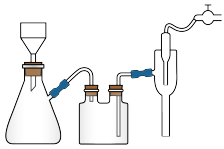
(4)抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是___________ 。
I.制备葡萄糖酸(装置如图所示)。

(1)仪器X的名称为

(2)滴入双氧水,水浴加热一段时间后,得到无色透明的葡萄糖酸溶液。反应的化学方程式为
Ⅱ.测定葡萄糖的转化率,确定合适的反应温度。
(3)用移液管取出三口烧瓶中的反应液2.00mL置于锥形瓶中,以酚酞作为指示剂并加20mL蒸馏水稀释,用0.04mol·L-1NaOH标准溶液滴定。
①滴定管使用的正确的操作顺序为蒸馏水洗涤→标准液润洗→
a.滴定结束后,记录刻度
b.调节液面至0刻度或0刻度略靠下,记录刻度
c.装入标准液并排净尖嘴处的气泡
d.将未滴定完的标准液回收
②达到滴定终点时的现象为
③滴定过程消耗NaOH标准溶液的体积为V0mL,反应后三口烧瓶内溶液的体积为V1mL,实验条件下葡萄糖的转化率为
④若滴定终点时俯视读数,对转化率的影响为
Ⅲ.制备葡萄糖酸钙。
将CaCO3分散于适量蒸馏水中形成浊液,加入葡萄糖酸,至无CO2气体放出为止,煮沸,并趁热采用下图装置抽滤,滤掉未反应的CaCO3,得到澄清透明的葡萄糖酸钙溶液。

(4)抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是
更新时间:2021-05-25 15:57:56
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某校化学兴趣小组的同学对一份含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品除样品外,还应有________ ;实验中应测定的数据有________ 。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.0000g,全部溶于水配制成1000.00mL溶液。配制该溶液所需要的主要玻璃仪器为_____________ 。
②用碱式滴定管量取20.0mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。
滴定管在使用前除用蒸馏水洗涤外,还应________ 。
③用浓度为0.1000mol·L-1的HCl标准溶液进行滴定。
④上述中和滴定中应选用的指示剂是________ ,终点时消耗标准液体积是24.00mL。
⑤样品中,NaOH的质量分数为________ 。
⑥ 若出现下列情况,导致测定结果偏高的是____ (填序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定前碱式滴定管没有用待测液润洗
c.滴定过程中不慎将滴酸溶液滴在锥形瓶外
d.酸式滴定管中滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有标准液润洗
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品除样品外,还应有
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.0000g,全部溶于水配制成1000.00mL溶液。配制该溶液所需要的主要玻璃仪器为
②用碱式滴定管量取20.0mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。
滴定管在使用前除用蒸馏水洗涤外,还应
③用浓度为0.1000mol·L-1的HCl标准溶液进行滴定。
④上述中和滴定中应选用的指示剂是
⑤样品中,NaOH的质量分数为
⑥ 若出现下列情况,导致测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定前碱式滴定管没有用待测液润洗
c.滴定过程中不慎将滴酸溶液滴在锥形瓶外
d.酸式滴定管中滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有标准液润洗
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至 开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下硝酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下硝酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
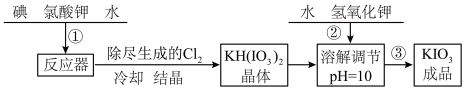
(1)步骤②中氢氧化钾的主要作用是_______
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过_______ 、过滤、洗涤、干燥等步骤
(3)已知: ;
;
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取 食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量
食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量 溶液,使
溶液,使 与
与 反应完全;最后加入指示剂,以物质的量浓度为
反应完全;最后加入指示剂,以物质的量浓度为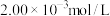 的
的 溶液滴定,消耗
溶液滴定,消耗 时恰好反应完全。
时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为_______ 、_______
②该实验可以用_______ 作指示剂,滴定终点的现象是_______
③下列有关该滴定实验的说法不正确的是_______
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低
 开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下硝酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下硝酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过
温度 | 20 | 40 | 60 | 80 |
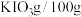 水 水 |  | 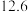 | 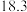 |  |
 ;
;
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取
 食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量
食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量 溶液,使
溶液,使 与
与 反应完全;最后加入指示剂,以物质的量浓度为
反应完全;最后加入指示剂,以物质的量浓度为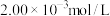 的
的 溶液滴定,消耗
溶液滴定,消耗 时恰好反应完全。
时恰好反应完全。①在滴定过程中,所用的玻璃仪器为
②该实验可以用
③下列有关该滴定实验的说法不正确的是
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作有以下四步(设该药片中的其他成分不与盐酸或氢氧化钠反应)
①配制0.1mol/L稀盐酸和0.1mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下列问题:
(1)正确的操作顺序是(填序号)______ 。
(2)测定过程中发生反应的离子方程式为______ ;______ 。
(3)该测定实验共进行了4次。实验室现有100mL、250mL两种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为______ ,理由是______ 。若配制过程中遇到下列情况,溶液的浓度是偏高、偏低还是不变?
①定容时超过刻度线______ (填偏高、偏低或不变);
②容量瓶内壁附有水珠而未进行干燥处理______ (填偏高、偏低或不变)。
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,这种药片中碳酸钙的质量分数为______ 。
①配制0.1mol/L稀盐酸和0.1mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下列问题:
(1)正确的操作顺序是(填序号)
(2)测定过程中发生反应的离子方程式为
(3)该测定实验共进行了4次。实验室现有100mL、250mL两种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为
①定容时超过刻度线
②容量瓶内壁附有水珠而未进行干燥处理
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)/mL] | 13.00 | 12.90 | 13.10 | 15.00 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室用50mL0.50mol·L-1盐酸、50mL0.50mol·L-1NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
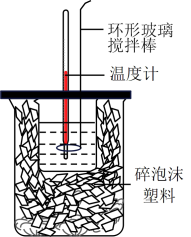
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)根据上表中所测数据进行计算,则该实验测得的中和热△H=__________ (盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容C按4.18J•(g•℃)-1计算,结果保留小数点后一位)。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,则实验中测得的“中和热”为△H1,则△H1与△H的关系为△H1________ △H(填“大于”、“小于”、“等于”)。如改用60mL0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH 溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”或“不相等”),所求中和热___ (填“相等”或“不相等”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是___ (填字母序号)。
A 测量盐酸的温度后,温度计没有用水冲洗干净
B 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C 做本实验的当天室温较高
D 将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E 在量取盐酸时仰视计数
F 大烧杯的盖板中间小孔太大.
实验次数 | 起始温度 | 终止温度 | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |

(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是
(2)根据上表中所测数据进行计算,则该实验测得的中和热△H=
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,则实验中测得的“中和热”为△H1,则△H1与△H的关系为△H1
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A 测量盐酸的温度后,温度计没有用水冲洗干净
B 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C 做本实验的当天室温较高
D 将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E 在量取盐酸时仰视计数
F 大烧杯的盖板中间小孔太大.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
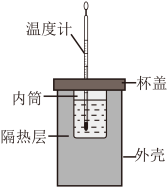
【推荐2】《化学反应原理》模块中涉及氢氧化钠溶液与稀盐酸反应的实验有两个:中和反应反应热的测定和酸碱中和滴定实验。
Ⅰ.中和反应反应热的测定。
将50 0.50
0.50 的盐酸与50
的盐酸与50 0.55
0.55 的
的 溶液加入如图所示的装置中,测定中和反应的反应热[已知:
溶液加入如图所示的装置中,测定中和反应的反应热[已知:
 ]。
]。___________ (填仪器名称)。
(2)实验所用 溶液浓度稍大于稀盐酸浓度的目的是
溶液浓度稍大于稀盐酸浓度的目的是___________ 。
(3)将量筒中的 溶液倒入内筒中的正确操作是
溶液倒入内筒中的正确操作是___________ (填字母)。
A.缓慢倒入B.分三次倒入C.一次迅速倒入
(4)现向三份1L1 的稀氢氧化钠溶液中分别滴加适量的稀硫酸、稀醋酸、浓硫酸,使氢氧化钠恰好完全反应,其生成1
的稀氢氧化钠溶液中分别滴加适量的稀硫酸、稀醋酸、浓硫酸,使氢氧化钠恰好完全反应,其生成1
 对应的反应热分别为
对应的反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 由小到大的顺序为
由小到大的顺序为___________ 。
Ⅱ.酸碱中和滴定实验:用标准 溶液滴定待测稀盐酸。
溶液滴定待测稀盐酸。___________ 。下列关于该仪器的使用方法正确的是___________ (填序号)。
①使用前需检查仪器是否漏水;
②先用水洗,再用相应溶液润洗2~3次;
(6)取20.00 待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.1000
待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.1000
 标准溶液进行滴定。重复上述滴定操作3次,记录所用
标准溶液进行滴定。重复上述滴定操作3次,记录所用 溶液的体积分别为18.05
溶液的体积分别为18.05 、17.95
、17.95 、18.00
、18.00 。
。
①达到滴定终点的标志是___________ 。
②该待测稀盐酸的浓度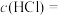
___________  。
。
③用 标准溶液滴定未知浓度的盐酸时,下列操作不会影响实验结果的是
标准溶液滴定未知浓度的盐酸时,下列操作不会影响实验结果的是___________ (填字母)。
A.碱式滴定管在滴定时未用标准 溶液润洗
溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测稀盐酸后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
Ⅰ.中和反应反应热的测定。
将50
 0.50
0.50 的盐酸与50
的盐酸与50 0.55
0.55 的
的 溶液加入如图所示的装置中,测定中和反应的反应热[已知:
溶液加入如图所示的装置中,测定中和反应的反应热[已知:
 ]。
]。
(2)实验所用
 溶液浓度稍大于稀盐酸浓度的目的是
溶液浓度稍大于稀盐酸浓度的目的是(3)将量筒中的
 溶液倒入内筒中的正确操作是
溶液倒入内筒中的正确操作是A.缓慢倒入B.分三次倒入C.一次迅速倒入
(4)现向三份1L1
 的稀氢氧化钠溶液中分别滴加适量的稀硫酸、稀醋酸、浓硫酸,使氢氧化钠恰好完全反应,其生成1
的稀氢氧化钠溶液中分别滴加适量的稀硫酸、稀醋酸、浓硫酸,使氢氧化钠恰好完全反应,其生成1
 对应的反应热分别为
对应的反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 由小到大的顺序为
由小到大的顺序为Ⅱ.酸碱中和滴定实验:用标准
 溶液滴定待测稀盐酸。
溶液滴定待测稀盐酸。
①使用前需检查仪器是否漏水;
②先用水洗,再用相应溶液润洗2~3次;
③排出该滴定管中气泡的方法应采用如图操作: (挤压玻璃球使尖嘴部分充满碱液);
(挤压玻璃球使尖嘴部分充满碱液);
(6)取20.00
 待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.1000
待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.1000
 标准溶液进行滴定。重复上述滴定操作3次,记录所用
标准溶液进行滴定。重复上述滴定操作3次,记录所用 溶液的体积分别为18.05
溶液的体积分别为18.05 、17.95
、17.95 、18.00
、18.00 。
。①达到滴定终点的标志是
②该待测稀盐酸的浓度
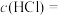
 。
。③用
 标准溶液滴定未知浓度的盐酸时,下列操作不会影响实验结果的是
标准溶液滴定未知浓度的盐酸时,下列操作不会影响实验结果的是A.碱式滴定管在滴定时未用标准
 溶液润洗
溶液润洗B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测稀盐酸后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为____ (填字母)。
A.用NaOH溶液润洗仪器并加入NaOH溶液
B.放出NaOH溶液进行滴定
C.调节起始读数
D.查漏,再水洗2~3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视____ 。
(3)排除碱式滴定管中气泡的方法应采用操作___ (填图编号),轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)滴定达到终点的标志是______ 。
(5)某学生根据三次实验分别记录有关数据如下表:
请选用其中合理的数据计算三次滴定用去NaOH的体积的平均值为__ ;该洗厕精中酸(盐酸)的物质的量浓度:c(HCl)=__ 。
(6)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:
A.若取待测液时,开始仰视读数,后俯视读数,则___ (填“偏大”、“偏小”或“无影响”);
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则____ (填“偏大”、“偏小”或“无影响”)。
(1)碱式滴定管的使用方法,正确步骤的先后顺序为
A.用NaOH溶液润洗仪器并加入NaOH溶液
B.放出NaOH溶液进行滴定
C.调节起始读数
D.查漏,再水洗2~3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视
(3)排除碱式滴定管中气泡的方法应采用操作

(4)滴定达到终点的标志是
(5)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测盐酸的体积 / mL | 0.100mol/L NaOH 溶液的体积/ mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 2.00 | 28.15 |
| 第二次 | 25.00 | 1.50 | 27.75 |
| 第三次 | 25.00 | 0.20 | 26.55 |
(6)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:
A.若取待测液时,开始仰视读数,后俯视读数,则
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】下列物质间有如下转化关系,请按要求填空。
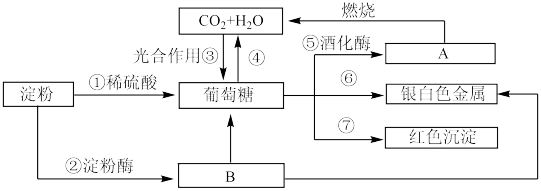
(1)在制镜工业和热水瓶胆镀银时,常利用上述反应________ (填序号)。
(2)反应①②的反应类型为_______ (填选项字母)。
A.氧化反应 B.加成反应 C.水解反应 D.消去反应
(3)反应⑦可用于检验糖尿病病人尿液中的含糖量,该反应的化学方程式为_________ 。

(1)在制镜工业和热水瓶胆镀银时,常利用上述反应
(2)反应①②的反应类型为
A.氧化反应 B.加成反应 C.水解反应 D.消去反应
(3)反应⑦可用于检验糖尿病病人尿液中的含糖量,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】选用合适的方法鉴别下列各组物质。
(1)乙醇与乙醛:_________ ;
(2)乙醇与乙酸:_________ ;
(3)乙醛与乙酸:_________ ;
(4)乙烷与乙炔:_________ ;
(5)苯与甲苯:_________ ;
(6)乙酸与乙酸乙酯:_________ ;
(7)苯甲醇水溶液与苯酚水溶液:_________ ;
(8)葡萄糖溶液与蔗糖溶液:_________ 。
(1)乙醇与乙醛:
(2)乙醇与乙酸:
(3)乙醛与乙酸:
(4)乙烷与乙炔:
(5)苯与甲苯:
(6)乙酸与乙酸乙酯:
(7)苯甲醇水溶液与苯酚水溶液:
(8)葡萄糖溶液与蔗糖溶液:
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐3】以淀粉为主要原料可以制得多种有机物,其合成路线如图所示:
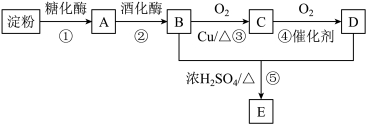
已知:A属于单糖,D能跟NaHCO3溶液反应产生CO2。
回答下列问题:
(1)A的分子式为_______ ,其中官能团的名称为_______ ;C的结构简式为_______ 。
(2)⑤的反应类型为_______ 。
(3)简述实验室中检验物质A的实验试剂、操作和现象_______ 。
(4)写出反应③的化学方程式:_______ 。
(5)与E具有相同官能团且互为同分异构体的有机物有3种,其中一种为HCOOCH2CH2CH3,另外两种物质的结构简式为_______ 。

已知:A属于单糖,D能跟NaHCO3溶液反应产生CO2。
回答下列问题:
(1)A的分子式为
(2)⑤的反应类型为
(3)简述实验室中检验物质A的实验试剂、操作和现象
(4)写出反应③的化学方程式:
(5)与E具有相同官能团且互为同分异构体的有机物有3种,其中一种为HCOOCH2CH2CH3,另外两种物质的结构简式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】如图所示装置可用于二氧化锰和浓盐酸在加热条件下反应制取纯净﹑干燥的氯气。
请回答下列问题:
(1)上述装置的正确连接顺序是(用导管口序号表示)____________________________________ 。
(2)饱和食盐水的作用是_________________________________________________________________ ;浓硫酸的作用是______________________________________________________ 。
(3)写出A中发生反应的化学方程式;____________________________________ 。
(4)用浓盐酸和二氧化锰制取氯气时,要缓缓加热,原因是___________________________________ 。

请回答下列问题:
(1)上述装置的正确连接顺序是(用导管口序号表示)
(2)饱和食盐水的作用是
(3)写出A中发生反应的化学方程式;
(4)用浓盐酸和二氧化锰制取氯气时,要缓缓加热,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
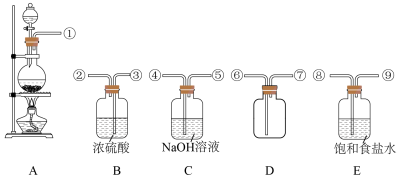
【推荐2】 是一种优良的消毒剂,常用于自来水的消毒,其沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。某学习小组在实验室通过反应:
是一种优良的消毒剂,常用于自来水的消毒,其沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。某学习小组在实验室通过反应: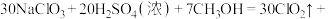
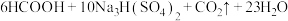 制备
制备 ,并将其转化为便于运输和贮存的
,并将其转化为便于运输和贮存的 固体,实验装置如下图所示。(已知:
固体,实验装置如下图所示。(已知: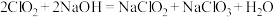 )
)
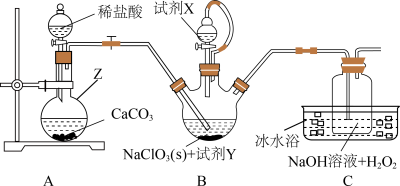
请回答下列问题:
(1)仪器Z的名称为_______ ,试剂X的名称为_______ 。
(2)实验过程中需持续通入一定量的 ,其目的是
,其目的是_______ ;反应结束后需再通入一定量的 ,其目的是
,其目的是_______ 。
(3)装置C中生成 的离子方程式为
的离子方程式为_______ 。
(4)设计实验证明 溶液具有氧化性:
溶液具有氧化性:_______ 。(可供选的试剂:稀 ,稀
,稀 、
、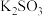 溶液、
溶液、 、
、 溶液、KSCN溶液)
溶液、KSCN溶液)
(5)上述装置存在一处明显的缺陷,其改进措施为_______ 。
(6)某同学欲测定经 消毒过的自来水中
消毒过的自来水中 残留量,他进行了如下实验:
残留量,他进行了如下实验:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL蒸馏水溶解后,再加入3mL稀硫酸;
Ⅱ.向锥形瓶中加入20.00mL自来水;
Ⅲ.用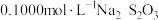 溶液测定锥形瓶中生成
溶液测定锥形瓶中生成 的量(
的量( ),共用去
),共用去 溶液。
溶液。
①步骤Ⅲ需加入的指示剂为_______ 。
②水样中 的含量为
的含量为_______ g/L。
 是一种优良的消毒剂,常用于自来水的消毒,其沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。某学习小组在实验室通过反应:
是一种优良的消毒剂,常用于自来水的消毒,其沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。某学习小组在实验室通过反应: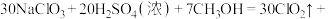
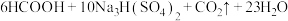 制备
制备 ,并将其转化为便于运输和贮存的
,并将其转化为便于运输和贮存的 固体,实验装置如下图所示。(已知:
固体,实验装置如下图所示。(已知: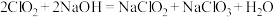 )
)
请回答下列问题:
(1)仪器Z的名称为
(2)实验过程中需持续通入一定量的
 ,其目的是
,其目的是 ,其目的是
,其目的是(3)装置C中生成
 的离子方程式为
的离子方程式为(4)设计实验证明
 溶液具有氧化性:
溶液具有氧化性: ,稀
,稀 、
、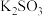 溶液、
溶液、 、
、 溶液、KSCN溶液)
溶液、KSCN溶液)(5)上述装置存在一处明显的缺陷,其改进措施为
(6)某同学欲测定经
 消毒过的自来水中
消毒过的自来水中 残留量,他进行了如下实验:
残留量,他进行了如下实验:Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL蒸馏水溶解后,再加入3mL稀硫酸;
Ⅱ.向锥形瓶中加入20.00mL自来水;
Ⅲ.用
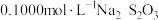 溶液测定锥形瓶中生成
溶液测定锥形瓶中生成 的量(
的量( ),共用去
),共用去 溶液。
溶液。①步骤Ⅲ需加入的指示剂为
②水样中
 的含量为
的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物,冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。
8Cu+4FeO+2Fe2O3+16SO2。
(1)若CuFeS2中Fe的化合价为+2价,则反应中的氧化产物是_______ (填化学式)。
(2)上述冶炼过程中会产生大量SO2,下列处理方案中合理的是_______ (填字母)。
A.高空排放 B.用于制备硫酸 C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
(3)验证黄铜矿冶炼铜的反应所得气体中含有SO2的方法是_______ 。
(4)实验室制备、收集干燥的SO2,所需装置如图。

①装置A产生SO2,反应的化学方程式为_______ 。
②按气流方向连接各仪器接口,顺序为a→_______ →_______ →_______ →_______ →f,装置E中NaOH溶液的作用是吸收多余的SO2,该反应的离子方程式为_______ 。
 8Cu+4FeO+2Fe2O3+16SO2。
8Cu+4FeO+2Fe2O3+16SO2。(1)若CuFeS2中Fe的化合价为+2价,则反应中的氧化产物是
(2)上述冶炼过程中会产生大量SO2,下列处理方案中合理的是
A.高空排放 B.用于制备硫酸 C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
(3)验证黄铜矿冶炼铜的反应所得气体中含有SO2的方法是
(4)实验室制备、收集干燥的SO2,所需装置如图。

①装置A产生SO2,反应的化学方程式为
②按气流方向连接各仪器接口,顺序为a→
您最近一年使用:0次



