(1)葡萄酒中SO2最大使用量为0.25g·L-1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
①碱式滴定管滴定前排气泡时,应选择图中的__ (填序号)

②若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___ (填序号)。
①=10mL ②=40mL ③<10mL ④>40mL。
③上述滴定实验中,可选择___ 为指示剂,选择该指示剂时如何判断反应到达滴定终点:__ 。
④滴定终点读数时俯视刻度线,则测量结果比实际值__ (填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
①正确操作步骤的顺序是(用序号字母填写)__ 。
②根据上述数据,可计算出该盐酸的浓度约为__ (保留两位有效数字)。
①碱式滴定管滴定前排气泡时,应选择图中的

②若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积
①=10mL ②=40mL ③<10mL ④>40mL。
③上述滴定实验中,可选择
④滴定终点读数时俯视刻度线,则测量结果比实际值
(2)某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
| 实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
更新时间:2021-05-12 17:09:34
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】(1)室温下,pH均为13的NaOH溶液中,水电离产生的c(OH—) = _______ 。
(2)室温下,取25 mL的pH=2的醋酸溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)___ c(CH3COO-),(填“>”或“<”或“=”)。取25 mL的pH=2的盐酸,加入等体积pH=12的氨水,反应后溶液中的溶质为_____ 。
(3)某课外兴趣小组用0.10mol·L-1标准盐酸滴定某NaOH溶液的浓度,用酚酞作指示剂。
①滴定终点时的现象为锥形瓶中的溶液由_____ 。
②滴定时边滴边摇动锥形瓶,眼睛应观察_____ 。
③下列操作可能使测定结果偏低的是_______ 。
A.酸式滴定管在装酸液前未用标准酸液润洗
B.开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失
C.装待测液的滴定管,放液前平视,后仰视
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
④已知测的下列数据:
则待测烧碱溶液的物质的量浓度为______ 。
(2)室温下,取25 mL的pH=2的醋酸溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)
(3)某课外兴趣小组用0.10mol·L-1标准盐酸滴定某NaOH溶液的浓度,用酚酞作指示剂。
①滴定终点时的现象为锥形瓶中的溶液由
②滴定时边滴边摇动锥形瓶,眼睛应观察
③下列操作可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准酸液润洗
B.开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失
C.装待测液的滴定管,放液前平视,后仰视
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
④已知测的下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
则待测烧碱溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】利用草酸(H2C2O4)及草酸盐的性质可测定人体血液中钙离子的浓度。
实验流程:取血样 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙(
]溶液,析出草酸钙( )沉淀,将此沉淀洗涤后溶于强酸得草酸(
)沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。
(1)KMnO4标准溶液应用______ (填“酸式”或“碱式”)滴定管盛装,注入KMnO4标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和___________ 。
(2)①滴定前,装有KMnO4标准液的滴定管排气泡时,应选择下图中的______ (填标号,下同)。
a. b.
b. c.
c. d.
d.
②若用25.00mL滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积______ 。
A. B.
B.  C.
C.  D.
D. 
(3)请写出滴定过程中发生的离子反应方程式:___________ 。
(4)判断达到滴定终点的现象是________ 。
(5)血液样品中Ca2+浓度为________  (保留2位有效数字)。
(保留2位有效数字)。
(6)以下操作会导致测定结果偏高的是_______ (填字母)。
a.装入KMnO4溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有半滴溶液 d.滴定过程中,振荡时将待测液洒出
实验流程:取血样
 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙(
]溶液,析出草酸钙( )沉淀,将此沉淀洗涤后溶于强酸得草酸(
)沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。(1)KMnO4标准溶液应用
(2)①滴定前,装有KMnO4标准液的滴定管排气泡时,应选择下图中的
a.
 b.
b. c.
c. d.
d.
②若用25.00mL滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积
A.
 B.
B.  C.
C.  D.
D. 
(3)请写出滴定过程中发生的离子反应方程式:
(4)判断达到滴定终点的现象是
(5)血液样品中Ca2+浓度为
 (保留2位有效数字)。
(保留2位有效数字)。(6)以下操作会导致测定结果偏高的是
a.装入KMnO4溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有半滴溶液 d.滴定过程中,振荡时将待测液洒出
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是___ (填编号),该错误操作会导致测定结果___ (填“偏大”、“偏小”或“无影响”)。
(2)实验中用左手控制___ ,眼睛注视___ ,直至滴定终点。判断滴定终点的现象是:锥形瓶中溶液___ 。
(3)如图是某次滴定时的滴定管中的液面,其读数为___ mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度为___ mol/L。
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是
(2)实验中用左手控制
(3)如图是某次滴定时的滴定管中的液面,其读数为

(4)根据下列数据:请计算待测盐酸溶液的浓度为
| 滴定次数 | 待测液体积(mL) | 标准液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.42 | 20.40 |
| 第二次 | 20.00 | 2.28 | 22.30 |
| 第三次 | 20.00 | 0.20 | 22.60 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得知,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;请回答:
(1)将草酸晶体配制成溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、_____ 、______ 。
(2)滴定时,将KMnO4标准液装在右图中的________ (填“甲”或“乙”)滴定管中。
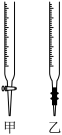
(3)本实验滴定达到终点的标志是________ 。
(4)通过上述数据,计算出x=________ 。
(5)下列滴定操作会使测得的x值偏大的是________ 。
A.滴定终点时俯视滴定管刻度
B. 滴定终点时仰视滴定管刻度
C.滴定时所用的KMnO4溶液因久置而导致浓度变小
D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;请回答:
(1)将草酸晶体配制成溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、
(2)滴定时,将KMnO4标准液装在右图中的

(3)本实验滴定达到终点的标志是
(4)通过上述数据,计算出x=
(5)下列滴定操作会使测得的x值偏大的是
A.滴定终点时俯视滴定管刻度
B. 滴定终点时仰视滴定管刻度
C.滴定时所用的KMnO4溶液因久置而导致浓度变小
D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:

(1)仪器A的名称是__________________ ;
(2)盐酸的体积读数:滴定前读数为_____ mL,滴定后读数为______ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________ ;(保留四位有效数字)
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________ ;
(5)判断到达滴定终点的实验现象是________________________________ 。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是_________ ;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失._________ ;
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是___________ ;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________ .

(1)仪器A的名称是
(2)盐酸的体积读数:滴定前读数为
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)
(5)判断到达滴定终点的实验现象是
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下图中______ (填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________ 。

(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________ (填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
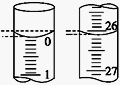
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________ mL。
(5)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算 该NaOH溶液的物质的量浓度(写出简要过程)。______________
(1)下图中

(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为

(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】酸碱中和滴定是重要的定量实验,用标准 溶液滴定某一元酸HA的浓度,回答下列问题:
溶液滴定某一元酸HA的浓度,回答下列问题:
(1)标准溶液的配制:用托盘天平称量 固体,配成
固体,配成 标准溶液,则
标准溶液,则 标准溶液的物质的量浓度为
标准溶液的物质的量浓度为_______ ,滴定时 溶液应装入
溶液应装入_______ (填仪器名称)
(2)滴定过程:用标定后的 标准溶液滴定一元酸HA。(用基准物质邻苯二甲酸氢钾
标准溶液滴定一元酸HA。(用基准物质邻苯二甲酸氢钾 标定
标定 标准溶液的浓度,结果为
标准溶液的浓度,结果为 )滴定时,最好选用
)滴定时,最好选用_______ 作为滴定的指示剂,使用该指示剂滴定时,滴定终点的现象是_______
(3)根据表中数据,该一元酸HA溶液的物质的量浓度是_______ (保留四位有效数字)
(4)下列操作会造成 的测定结果偏高的是_______
的测定结果偏高的是_______
(5)用 溶液滴定酸的浓度时,对酸的电离常数和起始浓度是有一定条件的,当起始浓度与电离常数满足
溶液滴定酸的浓度时,对酸的电离常数和起始浓度是有一定条件的,当起始浓度与电离常数满足 时可以比较准确的滴定。现有
时可以比较准确的滴定。现有 的四种酸它们的
的四种酸它们的 值如表,则根据数据判断,能用
值如表,则根据数据判断,能用 溶液滴定浓度的酸是
溶液滴定浓度的酸是_______ (填化学式)
 溶液滴定某一元酸HA的浓度,回答下列问题:
溶液滴定某一元酸HA的浓度,回答下列问题:(1)标准溶液的配制:用托盘天平称量
 固体,配成
固体,配成 标准溶液,则
标准溶液,则 标准溶液的物质的量浓度为
标准溶液的物质的量浓度为 溶液应装入
溶液应装入(2)滴定过程:用标定后的
 标准溶液滴定一元酸HA。(用基准物质邻苯二甲酸氢钾
标准溶液滴定一元酸HA。(用基准物质邻苯二甲酸氢钾 标定
标定 标准溶液的浓度,结果为
标准溶液的浓度,结果为 )滴定时,最好选用
)滴定时,最好选用(3)根据表中数据,该一元酸HA溶液的物质的量浓度是
| 滴定次数 | 待测溶液体积 | 标准溶液体积 | |
滴定前的刻度 | 滴定后的刻度 | ||
| 第1次 | 20.00 | 0.40 | 20.50 |
| 第2次 | 20.00 | 2.10 | 22.25 |
| 第3次 | 20.00 | 1.05 | 21.10 |
 的测定结果偏高的是_______
的测定结果偏高的是_______| A.锥形瓶用待测液润洗 |
| B.滴定过程中摇瓶幅度太大,将锥形瓶中溶液撒到瓶外 |
| C.滴定过程中向锥形瓶中加入少量蒸馏水 |
| D.滴定结束时,仰视读数 |
 溶液滴定酸的浓度时,对酸的电离常数和起始浓度是有一定条件的,当起始浓度与电离常数满足
溶液滴定酸的浓度时,对酸的电离常数和起始浓度是有一定条件的,当起始浓度与电离常数满足 时可以比较准确的滴定。现有
时可以比较准确的滴定。现有 的四种酸它们的
的四种酸它们的 值如表,则根据数据判断,能用
值如表,则根据数据判断,能用 溶液滴定浓度的酸是
溶液滴定浓度的酸是酸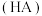 |  |  |  |  |
 | 4.2 | 5.1 | 2.8 | 2.4 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】为了测定含有 、
、 和
和 的试样中各物质的质量分数,进行如下实验
的试样中各物质的质量分数,进行如下实验
①称取 试样,加水溶解,配成
试样,加水溶解,配成 试样溶液.
试样溶液.
②用酸式滴定管量取 试样溶液放入锥形瓶中,并加入
试样溶液放入锥形瓶中,并加入 滴酚酞试液,用
滴酚酞试液,用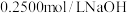 溶液滴定,消耗
溶液滴定,消耗 溶液
溶液 .
.
③再取 试样溶液放入另一锥形瓶中,用
试样溶液放入另一锥形瓶中,用 的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液
的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液 .已知:
.已知: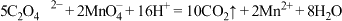
(1)已知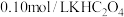 溶液
溶液 约为3,其中含碳元素的粒子浓度由大到小的顺序为
约为3,其中含碳元素的粒子浓度由大到小的顺序为___________ .
(2)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的 的质量分数
的质量分数___________ .(填“偏大”、“偏小”或“无影响”)
(3)步骤③中判断滴定终点的方法是___________________________________________________
(4)原试样中 的质量分数为
的质量分数为___________ , 的质量分数为
的质量分数为___________ .
 、
、 和
和 的试样中各物质的质量分数,进行如下实验
的试样中各物质的质量分数,进行如下实验①称取
 试样,加水溶解,配成
试样,加水溶解,配成 试样溶液.
试样溶液.②用酸式滴定管量取
 试样溶液放入锥形瓶中,并加入
试样溶液放入锥形瓶中,并加入 滴酚酞试液,用
滴酚酞试液,用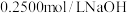 溶液滴定,消耗
溶液滴定,消耗 溶液
溶液 .
.③再取
 试样溶液放入另一锥形瓶中,用
试样溶液放入另一锥形瓶中,用 的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液
的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液 .已知:
.已知: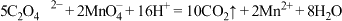
(1)已知
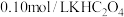 溶液
溶液 约为3,其中含碳元素的粒子浓度由大到小的顺序为
约为3,其中含碳元素的粒子浓度由大到小的顺序为(2)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的
 的质量分数
的质量分数(3)步骤③中判断滴定终点的方法是
(4)原试样中
 的质量分数为
的质量分数为 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】如图是用0.1000mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
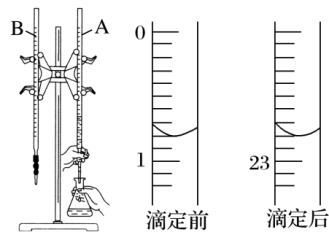
请回答下列问题:
(1)仪器A的名称是_______ 。
(2)盐酸的体积读数:滴定前读数为_______ mL,滴定后读数为_______ mL。
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是_______ mol·L-1(保留四位有效数字)。
(4)滴定终点的判断方法为_______ 。
(5)对下列几种假定情况进行讨论:
①取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,对测定结果的影响是_______ (填“偏高”“偏低”或“无影响”,下同);
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______ ;
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是_______ 。

请回答下列问题:
(1)仪器A的名称是
(2)盐酸的体积读数:滴定前读数为
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(5)对下列几种假定情况进行讨论:
①取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,对测定结果的影响是
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.0g样品溶于水,配成250mL溶液;②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol·L-1的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
请回答:
(1)将样品配成250mL溶液,除量筒,小烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有_____ 。
(2)向锥形瓶中待测液滴加2-3滴指示剂,用_____ (填“酸式”或“碱式”)滴定管盛装0.10mol·L-1的盐酸标准液滴定。
(3)滴定过程中眼睛注视,达到滴定终点时的标志为_____ 。
(4)烧碱样品的纯度为_____ 。
(5)用标准液滴定待测液,下列操作中导致中和滴定的测量值偏高的是_____ 。
a.锥形瓶用蒸馏水冲洗后,再用待测液润洗2~3次.
b.滴定开始时,滴定管尖嘴有气泡,滴定过程中气泡消失
c.滴定前读数时仰视,滴定后读数平视
d.摇动锥形瓶时,瓶中有少量液体溅出
e.滴定时,锥形瓶中加入少量蒸馏水
①称量1.0g样品溶于水,配成250mL溶液;②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol·L-1的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
| 滴定序号 | 待测液体积/(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(1)将样品配成250mL溶液,除量筒,小烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有
(2)向锥形瓶中待测液滴加2-3滴指示剂,用
(3)滴定过程中眼睛注视,达到滴定终点时的标志为
(4)烧碱样品的纯度为
(5)用标准液滴定待测液,下列操作中导致中和滴定的测量值偏高的是
a.锥形瓶用蒸馏水冲洗后,再用待测液润洗2~3次.
b.滴定开始时,滴定管尖嘴有气泡,滴定过程中气泡消失
c.滴定前读数时仰视,滴定后读数平视
d.摇动锥形瓶时,瓶中有少量液体溅出
e.滴定时,锥形瓶中加入少量蒸馏水
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】草酸 是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。
是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。
Ⅰ.酸碱中和滴定法。
已知:草酸氢钠溶液显酸性,溶液具有一定缓冲性,不易观察到滴定终点。
操作步骤:量取待测草酸溶液 于锥形瓶中,滴加2滴指示剂;将
于锥形瓶中,滴加2滴指示剂;将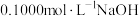 溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录
溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录 溶液的体积,再重复滴定3浓。记录数据如下:
溶液的体积,再重复滴定3浓。记录数据如下:
(1)该滴定过程中应选用的指示剂为___________ (填“酚酞”或“甲基橙”)。
(2)将 溶液盛装于滴定管后,霈要排尽滴定管尖嘴部分的气泡,并将液面调至“0”刻度或“0”刻度
溶液盛装于滴定管后,霈要排尽滴定管尖嘴部分的气泡,并将液面调至“0”刻度或“0”刻度___________ (填“以上”或“以下”);其中排气泡的正确操作为___________ (填字母)。
a. b.
b. c.
c.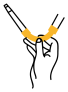 d.
d.
(3)由上述滴定结果可计算得c(草酸)=___________  。
。
(4)若出现下列情况,测定结果偏高的是___________(填字母)。
Ⅱ.氧化还原滴定法。用已知浓度的 溶液滴定该草酸溶液。
溶液滴定该草酸溶液。
(5)滴定过程中涉及反应的离子方程式为___________ 。
(6)量取草酸溶液体积和滴定时盛装 溶液的滴定管分别为
溶液的滴定管分别为___________ 、___________ (填“酸式滴定管”或“碱式滴定管”),滴定至终点的现象为___________ 。
 是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。
是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。Ⅰ.酸碱中和滴定法。
已知:草酸氢钠溶液显酸性,溶液具有一定缓冲性,不易观察到滴定终点。
操作步骤:量取待测草酸溶液
 于锥形瓶中,滴加2滴指示剂;将
于锥形瓶中,滴加2滴指示剂;将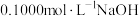 溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录
溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录 溶液的体积,再重复滴定3浓。记录数据如下:
溶液的体积,再重复滴定3浓。记录数据如下:| 滴定次数 | 1 | 2 | 3 | 4 |
V(草酸) | 10.00 | 10.00 | 10.00 | 10.00 |
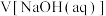 (消耗) (消耗) | 15.95 | 15.00 | 15.02 | 14.98 |
(2)将
 溶液盛装于滴定管后,霈要排尽滴定管尖嘴部分的气泡,并将液面调至“0”刻度或“0”刻度
溶液盛装于滴定管后,霈要排尽滴定管尖嘴部分的气泡,并将液面调至“0”刻度或“0”刻度a.
 b.
b. c.
c. d.
d.
(3)由上述滴定结果可计算得c(草酸)=
 。
。(4)若出现下列情况,测定结果偏高的是___________(填字母)。
| A.滴定前用蒸馏水冲洗锥形瓶 |
| B.在振荡锥形瓶时不慎将瓶内溶液溅出 |
| C.滴定至终点时,俯视读数 |
D.用蒸馏水清洗滴定管后,未用 标准液润洗 标准液润洗 |
Ⅱ.氧化还原滴定法。用已知浓度的
 溶液滴定该草酸溶液。
溶液滴定该草酸溶液。(5)滴定过程中涉及反应的离子方程式为
(6)量取草酸溶液体积和滴定时盛装
 溶液的滴定管分别为
溶液的滴定管分别为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某学生用0.1000mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.调节液面至“0”或“0”以下某一刻度,记下读数
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.用标准溶液润洗滴定管2~3次
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)A→
(2)若无上述E步骤操作,则测定结果会
(3)上述A步骤之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是
(4)判断到达滴定终点的现象是
(5)若甲学生在实验过程中,记录滴定前滴定管内液面读数为2.60mL,滴定后液面如图,则此时消耗标准溶液的体积为

(6)乙学生做了三组平行实验,数据记录如表:选取下述合理数据,计算出待测溶液的物质的量浓度为
实验序号 | 待测HCl溶液的体积/mL | 0.1000mol•L-1的KOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 25.02 |
2 | 25.00 | 0.00 | 30.00 |
3 | 25.00 | 1.00 | 25.98 |
您最近一年使用:0次



