苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
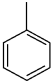 +KMnO4→
+KMnO4→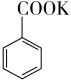 + MnO2
+ MnO2 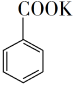 +HCl→
+HCl→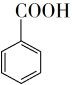 +KCl
+KCl
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25.00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______ (填标号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)在反应装置中应选用______ 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是______ 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________ ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理__________  。
。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______ 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______ 。
(6)本实验制备的苯甲酸的纯度为_______ 。
(7)若要得到纯度更高的苯甲酸,可通过__________ 方法提纯。
 +KMnO4→
+KMnO4→ + MnO2
+ MnO2  +HCl→
+HCl→ +KCl
+KCl| 名称 | 相对分 子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·mL−1) | 溶解性 |
| 甲苯 | 92 | −95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25.00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)在反应装置中应选用
(3)加入适量饱和亚硫酸氢钠溶液的目的是
 。
。(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
(6)本实验制备的苯甲酸的纯度为
(7)若要得到纯度更高的苯甲酸,可通过
更新时间:2021-05-19 06:13:53
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】有“退热冰”之称的乙酰苯胺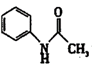 具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(
具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(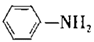 )和乙酸反应(该反应是放热反应)制得。
)和乙酸反应(该反应是放热反应)制得。
已知:
1.苯胺在空气中易被氧化。
2.可能用到的有关性质如下:
Ⅰ.制备乙酰苯胺的实验步骤如下:
步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。
步骤2:小火加热回流1h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。
请回答下列问题:
(1)写出制备乙酰苯胺的化学方程式___ 。
(2)将三种试剂混合时,最后加入的试剂是___ ,这样做的原因是:___ 。
(3)步骤2:小火加热回流1h,装置如图所示。请回答下列问题:
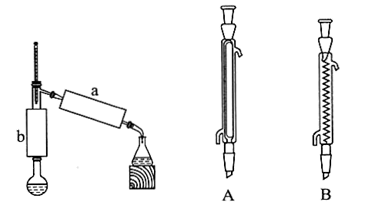
①b处使用的仪器为___ (填“A”或“B”),该仪器的名称是___ 。
②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是___ 。
Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示:

(4)从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是:___ 。
(5)①该实验最终得纯品10.8g,则乙酰苯胺的产率是___ 。(精确到小数点后1位)
②导致实际值低于理论值的原因可能是___ (填字母标号)。
A.没有等充分冷却就开始过滤
B.抽滤后没有把滤液合并在一起
C.乙酰苯胺中的乙酸未除干净
 具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(
具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(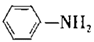 )和乙酸反应(该反应是放热反应)制得。
)和乙酸反应(该反应是放热反应)制得。已知:
1.苯胺在空气中易被氧化。
2.可能用到的有关性质如下:
| 名称 | 相对分子质量 | 性状 | 密度/g∙cm3 | 熔点/℃ | 沸点/℃ | 溶解度 | |
| g/100g水 | g/100g乙醇 | ||||||
| 苯胺 | 93 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
| 冰醋酸 | 60 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
| 乙酰苯胺 | 135 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。
步骤2:小火加热回流1h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。
请回答下列问题:
(1)写出制备乙酰苯胺的化学方程式
(2)将三种试剂混合时,最后加入的试剂是
(3)步骤2:小火加热回流1h,装置如图所示。请回答下列问题:

①b处使用的仪器为
②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是
Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示:

(4)从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是:
(5)①该实验最终得纯品10.8g,则乙酰苯胺的产率是
②导致实际值低于理论值的原因可能是
A.没有等充分冷却就开始过滤
B.抽滤后没有把滤液合并在一起
C.乙酰苯胺中的乙酸未除干净
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某兴趣小组利用葡萄糖酸钙[Ca(C6H11O7)2]与硫酸锌反应制备葡萄糖酸锌[Zn(C6H11O7)2]的流程为:
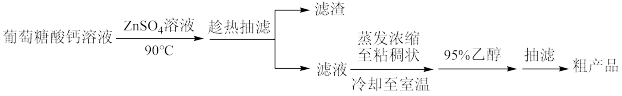
已知:①有关物质在水和乙醇中的溶解性:
②葡萄糖酸锌稍高于100℃即开始分解。
回答下列问题:
(1)反应须控温90℃,可以采用的加热方式为___ ,反应控温在90℃的原因为___ 。
(2)“趁热抽滤”的目的是___ 。在“蒸发浓缩至黏稠状,冷却至室温”后添加95%乙醇的作用是___ 。
(3)对粗产品进行提纯操作的名称是___ 。
(4)用EDTA(乙二胺四乙酸的二钠盐)滴定法测定粗产品中锌的含量,步骤如下:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTA10.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为___ 。
②该粗产品中Zn的质量分数为___ 。已知葡萄糖酸锌中Zn的质量分数为14.29%,则造成此次测定结果偏差的可能原因是___ 。
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管

已知:①有关物质在水和乙醇中的溶解性:
| 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 | |
| 水 | 可溶于冷水,易溶于热水 | 易溶 | 微溶 | |
| 乙醇 | 微溶 | 难溶 | ||
回答下列问题:
(1)反应须控温90℃,可以采用的加热方式为
(2)“趁热抽滤”的目的是
(3)对粗产品进行提纯操作的名称是
(4)用EDTA(乙二胺四乙酸的二钠盐)滴定法测定粗产品中锌的含量,步骤如下:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTA10.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为
②该粗产品中Zn的质量分数为
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】己二酸是一种二元弱酸,通常为白色结晶体,微溶于冷水,易溶于热水和乙醇。
I.制备己二酸的一种反应机理如下: +HNO3(浓)
+HNO3(浓) HOOC(CH2)4COOH+NO2↑+H2O(未配平)。制备己二酸的装置如图所示(夹持、加热装置省略)。
HOOC(CH2)4COOH+NO2↑+H2O(未配平)。制备己二酸的装置如图所示(夹持、加热装置省略)。

(1)向三颈烧瓶中加入2mL浓HNO3,再缓慢滴加1mL环己醇,保持80℃持续反应2h。反应结束冷却至室温后,在冰水浴中冷却,分离出己二酸粗品,用冰水浴的目的是______ 。分离出己二酸粗品时,所用的玻璃仪器有______ 。
(2)图中装置的缺陷为______ 。
Ⅱ.用浓HNO3做氧化剂的合成方法中,浓HNO3会严重腐蚀设备。科学家改进了合成己二酸的方法,以环己醇( )为原料制取己二酸HOOC(CH2)4COOH的实验流程如图:
)为原料制取己二酸HOOC(CH2)4COOH的实验流程如图:

已知:①“氧化”过程在(如图所示)三颈烧瓶中进行,发生的主要反应为:
 KOOC(CH2)4COOK △H<0
KOOC(CH2)4COOK △H<0
②不同温度下,相关物质在水中的溶解度:
回答下列问题:
(3)图1中冷却水从冷凝管_______ (填“a”或“b”)口流入。

(4)“氧化”过程,在不同环己醇滴速下,溶液温度随时间变化曲线如图2,应选择的环己醇滴速为____ 滴/min。
(5)流程中操作1为______ (填“趁热”或“冷却”)减压过滤,操作2为_____ 。
(6)流程中最后一次洗涤沉淀的方法为______ (填字母)。
A.用乙醇洗涤 B.用热水洗涤 C.用冷水洗涤
(7)除去己二酸晶体中含有的氯化钠杂质采取的实验方法为______ 。
(8)称取己二酸(M=146g/mol)样品0.2920g,用新煮沸的50.00mL热水溶解,滴入2滴酚酞试液作指示剂,用0.1500mol·L-1NaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为20.00mL,计算己二酸样品的纯度。(已知:己二酸的电离平衡常数:Ka1=3.8×10-5,Ka2=3.9×10-6)
①滴定终点的现象为:滴入最后一滴NaOH溶液,_______ 。
②己二酸样品的纯度为______ (保留4位有效数字)。
I.制备己二酸的一种反应机理如下:
 +HNO3(浓)
+HNO3(浓) HOOC(CH2)4COOH+NO2↑+H2O(未配平)。制备己二酸的装置如图所示(夹持、加热装置省略)。
HOOC(CH2)4COOH+NO2↑+H2O(未配平)。制备己二酸的装置如图所示(夹持、加热装置省略)。
(1)向三颈烧瓶中加入2mL浓HNO3,再缓慢滴加1mL环己醇,保持80℃持续反应2h。反应结束冷却至室温后,在冰水浴中冷却,分离出己二酸粗品,用冰水浴的目的是
(2)图中装置的缺陷为
Ⅱ.用浓HNO3做氧化剂的合成方法中,浓HNO3会严重腐蚀设备。科学家改进了合成己二酸的方法,以环己醇(
 )为原料制取己二酸HOOC(CH2)4COOH的实验流程如图:
)为原料制取己二酸HOOC(CH2)4COOH的实验流程如图:
已知:①“氧化”过程在(如图所示)三颈烧瓶中进行,发生的主要反应为:

 KOOC(CH2)4COOK △H<0
KOOC(CH2)4COOK △H<0②不同温度下,相关物质在水中的溶解度:
| 物质 | 己二酸 | 氯化钠 | 氯化钾 |
| 25℃时溶解度/g | 2.1 | 36.1 | 34.3 |
| 70℃时溶解度/g | 68 | 37.8 | 48 |
| 100℃时溶解度/g | 160 | 39.5 | 56.3 |
(3)图1中冷却水从冷凝管

(4)“氧化”过程,在不同环己醇滴速下,溶液温度随时间变化曲线如图2,应选择的环己醇滴速为
(5)流程中操作1为
(6)流程中最后一次洗涤沉淀的方法为
A.用乙醇洗涤 B.用热水洗涤 C.用冷水洗涤
(7)除去己二酸晶体中含有的氯化钠杂质采取的实验方法为
(8)称取己二酸(M=146g/mol)样品0.2920g,用新煮沸的50.00mL热水溶解,滴入2滴酚酞试液作指示剂,用0.1500mol·L-1NaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为20.00mL,计算己二酸样品的纯度。(已知:己二酸的电离平衡常数:Ka1=3.8×10-5,Ka2=3.9×10-6)
①滴定终点的现象为:滴入最后一滴NaOH溶液,
②己二酸样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】2-(对甲基苯基)苯并咪唑(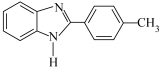 )是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺(
)是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺(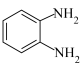 )和对甲基苯甲酸(
)和对甲基苯甲酸( )合成2-(对甲基苯基)苯并咪唑的反应过程如下:
)合成2-(对甲基苯基)苯并咪唑的反应过程如下:

向反应装置(如图)中加入0.1 mol邻苯二胺和0.15 mol对甲基苯甲酸后,再加入适量多聚磷酸(能与水互溶的质子酸),搅拌成糊状物,慢慢升温至100℃并搅拌1h,继续加热至190℃,回流2h,冷却。用10%的NaOH溶液调至微碱性,有大量固体出现,分离晶体,水洗,经重结晶提纯后,得白色针状晶体产品14.6 g.回答下列问题:
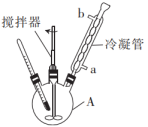
(1)仪器A的名称为___________ ,冷却水的流向为___________ (填“a进b出”或“b进a出”)。
(2)制备过程中需在190℃下回流2h,可采取的加热方式为___________ (填“水浴加热”或“油浴加热”)。
(3)“分离结晶”得到晶体与母液,其操作名称为___________ ,加入10%的NaOH溶液的作用为___________ ;分离完成后“水洗”的具体操作为___________ 。
(4)粗产品一般需要通过重结晶的方法来提纯,步骤为加热溶解→活性炭脱色→趁热过滤→冷却结晶→过滤→洗涤→干燥,其中需要趁热过滤的原因是___________ ;趁热过滤时所得滤渣中一定含有___________ (填名称)。
(5)2-(对甲基苯基)苯并咪唑的产率为___________ (保留三位有效数字)。
 )是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺(
)是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺( )和对甲基苯甲酸(
)和对甲基苯甲酸( )合成2-(对甲基苯基)苯并咪唑的反应过程如下:
)合成2-(对甲基苯基)苯并咪唑的反应过程如下:
向反应装置(如图)中加入0.1 mol邻苯二胺和0.15 mol对甲基苯甲酸后,再加入适量多聚磷酸(能与水互溶的质子酸),搅拌成糊状物,慢慢升温至100℃并搅拌1h,继续加热至190℃,回流2h,冷却。用10%的NaOH溶液调至微碱性,有大量固体出现,分离晶体,水洗,经重结晶提纯后,得白色针状晶体产品14.6 g.回答下列问题:

(1)仪器A的名称为
(2)制备过程中需在190℃下回流2h,可采取的加热方式为
(3)“分离结晶”得到晶体与母液,其操作名称为
(4)粗产品一般需要通过重结晶的方法来提纯,步骤为加热溶解→活性炭脱色→趁热过滤→冷却结晶→过滤→洗涤→干燥,其中需要趁热过滤的原因是
(5)2-(对甲基苯基)苯并咪唑的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】已知1,2-二氯乙烷在常温下为无色液体,沸点为83.5℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂;乙醇的沸点为78℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置。请回答下列问题:

(1)为了检查整套装置的气密性,某同学将导管末端插入盛有水的烧杯中,用双手捂着装置A中大试管,但该方法并不能准确说明装置的气密性是否良好。则正确检查整套装置气密性的方法是___________ 。
(2)向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入___________ ,目的是___________ ,并向装置C中试管里加入适量溴水。
(3)为了使反应在75℃左右进行,常用的方法是___________ 。
(4)与装置A中大试管相连接的长玻璃导管的作用是___________ 。
(5)能证明1,2-二氯乙烷已发生消去反应的实验现象是___________ ,装置A、C中发生反应的化学方程式分别为___________ 、___________ 。

(1)为了检查整套装置的气密性,某同学将导管末端插入盛有水的烧杯中,用双手捂着装置A中大试管,但该方法并不能准确说明装置的气密性是否良好。则正确检查整套装置气密性的方法是
(2)向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入
(3)为了使反应在75℃左右进行,常用的方法是
(4)与装置A中大试管相连接的长玻璃导管的作用是
(5)能证明1,2-二氯乙烷已发生消去反应的实验现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】有机物的反应往往伴随副反应发生,因此需要分离提纯。有一种水果香精的合成步骤如下:

Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
Ⅱ分离提纯:
①当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分振荡后静置,分去水层。
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO4•7H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
制备过程中还可能与的副反应有2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式____________ 。
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从______ (填a或b)管口通入。
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、_________ 、___________ 。
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________ (填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有___________________ 杂质。
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在_______ 中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.石蜡油(沸点200~300℃) D.沙子
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为_______ 。

Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
Ⅱ分离提纯:
①当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分振荡后静置,分去水层。
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO4•7H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在
A.水 B.甘油(沸点290℃) C.石蜡油(沸点200~300℃) D.沙子
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)

(1)A装置中通入a气体的目的是(用离子方程式表示)____ 。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是____ 。
(3)B装置中通入的b气体是____ ,目的是使溴蒸气转化为氢溴酸以达到富集的目的,试写出该反应的化学方程式____ 。
(4)C装置的作用是____ 。

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)

(1)A装置中通入a气体的目的是(用离子方程式表示)
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是
(3)B装置中通入的b气体是
(4)C装置的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某兴趣小组利用图甲装置(夹持装置略)收集某葡萄酒中的 ,并对其含量进行测定。某标准中规定葡萄酒中
,并对其含量进行测定。某标准中规定葡萄酒中 最大使用量为
最大使用量为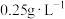 。
。

回答下列问题:
(1)仪器
 的名称是
的名称是 的进口为
的进口为 ”或“
”或“ ”)。
”)。(2)
 中加入
中加入 葡萄酒和适量稀硫酸,加热使
葡萄酒和适量稀硫酸,加热使 全部逸出并与仪器
全部逸出并与仪器 中
中 完全反应。仪器
完全反应。仪器 中发生反应的化学方程式为
中发生反应的化学方程式为(3)除去
 中过量的
中过量的 ,然后用
,然后用 标准溶液进行滴定,滴定前排气泡时,应选择图乙中的
标准溶液进行滴定,滴定前排气泡时,应选择图乙中的 滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积
滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积a.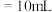 b.
b.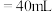 c.
c.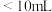 d.
d.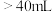
(4)判断滴定达到终点的现象为
 溶液
溶液 ,该葡萄酒中
,该葡萄酒中 含量为
含量为 。
。(5)下列操作会导致实验结果偏低的是
a.滴定管在装液前未用标准溶液润洗
b.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴浅出
c.达到滴定终点时,仰视读数
d.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】高温下普通铁粉和水蒸气反应生成四氧化三铁,四氧化三铁被氢气还原生成颗粒很细、活性很高的铁粉,俗称“引火铁”。现用普通铁粉、稀盐酸、金属锌和水等试剂制备“引火铁”,装置如下:

请填写下列空白:
(1)由四氧化三铁制取“引火铁”选用装置_______ 。(填“图1”或“图2”)
(2)为了安全,在试管E中的反应发生前,导管F出口处的气体必须_______ 。
(3)试管A中发生反应的化学方程式_______ 。
(4)实验中需要加热的仪器有_______ (填该仪器对应的字母)
(5)烧瓶C的作用_______ ;实验时,U形管G中应加入的试剂_______ 。

请填写下列空白:
(1)由四氧化三铁制取“引火铁”选用装置
(2)为了安全,在试管E中的反应发生前,导管F出口处的气体必须
(3)试管A中发生反应的化学方程式
(4)实验中需要加热的仪器有
(5)烧瓶C的作用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】草酸亚铁晶体 是一种黄色难溶于水可溶于稀硫酸的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:
是一种黄色难溶于水可溶于稀硫酸的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:

(1)仪器a的名称是__________ 。
(2)从绿色化学考虑,该套装置存在的明显缺陷是__________ 。
(3)实验前先通入一段时间 ,其目的为
,其目的为__________ 。
(4)实验证明了气体产物中含有CO,依据的实验现象为__________ 。
(5)草酸亚铁晶体在空气中易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是__________ 。
(6)加热时a中无水硫酸铜变蓝,则说明有:__________ 产生。
 是一种黄色难溶于水可溶于稀硫酸的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:
是一种黄色难溶于水可溶于稀硫酸的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:
(1)仪器a的名称是
(2)从绿色化学考虑,该套装置存在的明显缺陷是
(3)实验前先通入一段时间
 ,其目的为
,其目的为(4)实验证明了气体产物中含有CO,依据的实验现象为
(5)草酸亚铁晶体在空气中易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是
(6)加热时a中无水硫酸铜变蓝,则说明有:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组同学设计了如图所示的实验装置进行氨的催化氧化的实验:

(1)A中是一种黑色的固体,该装置制备氧气的化学方程式为_______ ,B装置是制备氨气的装置,B连接的分液漏斗中装的液体为_______ ,D中装的试剂可选择_______ (填编号)。
①无水硫酸铜②碱石灰③五氧化二磷④无水氯化钙
(2)E中发生氨的催化氧化,其化学方程式为_______ 。甲、乙同学分别按图示装置进行实验,一段时间后,装置G中的溶液都变成蓝色,G中溶液变蓝的原因是(用离子方程式表示)_______ ,甲观察到装置F中有红棕色气体,乙观察到装置F中有白烟生成。白烟的成分为_______ 。(填化学式)

(1)A中是一种黑色的固体,该装置制备氧气的化学方程式为
①无水硫酸铜②碱石灰③五氧化二磷④无水氯化钙
(2)E中发生氨的催化氧化,其化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】富马酸亚铁(结构简式为 ,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与
,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与 反应得富马酸亚铁。
反应得富马酸亚铁。
已知:
ⅰ、制备富马酸亚铁:
①将富马酸置于100mL烧杯中,加热水搅拌
②加入 溶液10mL使溶液pH为6.5—6.7.并将上述溶液移至100mL容器甲中
溶液10mL使溶液pH为6.5—6.7.并将上述溶液移至100mL容器甲中
③安装好回流装置乙,加热至沸。然后通过恒压滴液漏斗丙缓慢加入 溶液30mL
溶液30mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量
回答以下问题:
(1)该实验涉及到的主要仪器需从以下各项选择,则甲为___________ (填字母),乙为___________ (填名称)。

(2)已知反应容器中反应物 和富马酸按恰好完全反应的比例进行起始投料,步骤②中加入的
和富马酸按恰好完全反应的比例进行起始投料,步骤②中加入的 溶液要适量,若
溶液要适量,若 溶液加入过量,溶液pH偏高,则制得产品可能含有
溶液加入过量,溶液pH偏高,则制得产品可能含有___________ (填写化学式)。
(3)配制 溶液时,将
溶液时,将 固体溶于30mL新煮沸过的冷水中,同时加入适量的铁粉,加入铁粉的目的是
固体溶于30mL新煮沸过的冷水中,同时加入适量的铁粉,加入铁粉的目的是___________ 。
(4)判断步骤中④中富马酸亚铁产品已洗净的实验方法是___________ 。
ⅱ、富马酸亚铁纯度测定
步骤①:准确称取粗产品0.1600g,加煮沸过的3mol/L 溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲—亚铁指示剂,立即用0.050mo/L的硫酸高铈铵
溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲—亚铁指示剂,立即用0.050mo/L的硫酸高铈铵 标准溶液进行滴定,用去标准液的体积为16.02mL反应式为
标准溶液进行滴定,用去标准液的体积为16.02mL反应式为 。
。
步骤②:不加产品,重复步骤①操作,滴定终点用去标准液0.02mL。
(5)根据上述数据可得产品中富马酸亚铁的质量分数为___________ %(保留3位有效数字)。该滴定过程的标准液不宜为酸性高锰酸钾溶液,原因是___________ 。
 ,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与
,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与 反应得富马酸亚铁。
反应得富马酸亚铁。已知:
| 物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
| 富马酸 |  | 116 |   |
| 碳酸 | 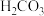 | 62 | 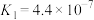  |
| 富马酸亚铁 | 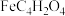 | 170 |
①将富马酸置于100mL烧杯中,加热水搅拌
②加入
 溶液10mL使溶液pH为6.5—6.7.并将上述溶液移至100mL容器甲中
溶液10mL使溶液pH为6.5—6.7.并将上述溶液移至100mL容器甲中③安装好回流装置乙,加热至沸。然后通过恒压滴液漏斗丙缓慢加入
 溶液30mL
溶液30mL④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量
回答以下问题:
(1)该实验涉及到的主要仪器需从以下各项选择,则甲为

(2)已知反应容器中反应物
 和富马酸按恰好完全反应的比例进行起始投料,步骤②中加入的
和富马酸按恰好完全反应的比例进行起始投料,步骤②中加入的 溶液要适量,若
溶液要适量,若 溶液加入过量,溶液pH偏高,则制得产品可能含有
溶液加入过量,溶液pH偏高,则制得产品可能含有(3)配制
 溶液时,将
溶液时,将 固体溶于30mL新煮沸过的冷水中,同时加入适量的铁粉,加入铁粉的目的是
固体溶于30mL新煮沸过的冷水中,同时加入适量的铁粉,加入铁粉的目的是(4)判断步骤中④中富马酸亚铁产品已洗净的实验方法是
ⅱ、富马酸亚铁纯度测定
步骤①:准确称取粗产品0.1600g,加煮沸过的3mol/L
 溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲—亚铁指示剂,立即用0.050mo/L的硫酸高铈铵
溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲—亚铁指示剂,立即用0.050mo/L的硫酸高铈铵 标准溶液进行滴定,用去标准液的体积为16.02mL反应式为
标准溶液进行滴定,用去标准液的体积为16.02mL反应式为 。
。步骤②:不加产品,重复步骤①操作,滴定终点用去标准液0.02mL。
(5)根据上述数据可得产品中富马酸亚铁的质量分数为
您最近一年使用:0次



