某兴趣小组利用葡萄糖酸钙[Ca(C6H11O7)2]与硫酸锌反应制备葡萄糖酸锌[Zn(C6H11O7)2]的流程为:
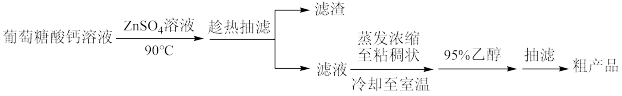
已知:①有关物质在水和乙醇中的溶解性:
②葡萄糖酸锌稍高于100℃即开始分解。
回答下列问题:
(1)反应须控温90℃,可以采用的加热方式为___ ,反应控温在90℃的原因为___ 。
(2)“趁热抽滤”的目的是___ 。在“蒸发浓缩至黏稠状,冷却至室温”后添加95%乙醇的作用是___ 。
(3)对粗产品进行提纯操作的名称是___ 。
(4)用EDTA(乙二胺四乙酸的二钠盐)滴定法测定粗产品中锌的含量,步骤如下:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTA10.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为___ 。
②该粗产品中Zn的质量分数为___ 。已知葡萄糖酸锌中Zn的质量分数为14.29%,则造成此次测定结果偏差的可能原因是___ 。
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管

已知:①有关物质在水和乙醇中的溶解性:
| 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 | |
| 水 | 可溶于冷水,易溶于热水 | 易溶 | 微溶 | |
| 乙醇 | 微溶 | 难溶 | ||
回答下列问题:
(1)反应须控温90℃,可以采用的加热方式为
(2)“趁热抽滤”的目的是
(3)对粗产品进行提纯操作的名称是
(4)用EDTA(乙二胺四乙酸的二钠盐)滴定法测定粗产品中锌的含量,步骤如下:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTA10.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为
②该粗产品中Zn的质量分数为
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管
更新时间:2021-05-25 18:07:28
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛___________ 。
(2)滴定终点的判断:___________ 。
(3)某学生根据3次实验分别记录有关数据如表:
根据表中数据该NaOH溶液的物质的量浓度为___________ 。
(4)以下操作会导致测得的NaOH溶液浓度偏高的是___________。
(5)氧化还原滴定实验的原理与中和滴定相同,即用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。为测定某样品中所含晶体 的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用
的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用 溶液滴定(杂质与
溶液滴定(杂质与 不反应)。若消耗
不反应)。若消耗
 溶液20.00mL,所得晶体中
溶液20.00mL,所得晶体中 的质量分数为
的质量分数为___________ (用a表示, 的摩尔质量为
的摩尔质量为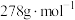 )。
)。
(1)用标准盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛
(2)滴定终点的判断:
(3)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 4.21 | 30.31 |
| 第三次 | 25.00 | 0.22 | 26.31 |
(4)以下操作会导致测得的NaOH溶液浓度偏高的是___________。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(5)氧化还原滴定实验的原理与中和滴定相同,即用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。为测定某样品中所含晶体
 的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用
的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用 溶液滴定(杂质与
溶液滴定(杂质与 不反应)。若消耗
不反应)。若消耗
 溶液20.00mL,所得晶体中
溶液20.00mL,所得晶体中 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为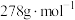 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】学习小组在实验字研究SO2并进行相关性质的探究。葡萄酒中SO2最大使用量0.25g∙L-1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol∙L-1NaOH标准溶液进行滴定。(相对原子质量S:32;O:16)
(1)如图所示,仪器A的名称___________ 。
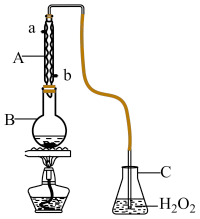
(2)写出SO2气体与H2O2溶液反应的化学方程式___________ 。
(3)上述滴定实验中若滴定终点时溶液的pH=8.8,可选择___________ 为指示剂,选择该指示剂时如何判断反应到达滴定终点___________ 。
(4)滴定前读数时平视凹液面,滴定终点读数时俯视刻度线,则测量结果比实际值___________ (填“偏高”“偏低”或“无影响”)。
(5)滴定至终点时,消耗NaOH溶液20.00mL,则该葡萄酒中SO2的含量为___________ ,是否超标?___________ (填“是”或“否”)
(1)如图所示,仪器A的名称

(2)写出SO2气体与H2O2溶液反应的化学方程式
(3)上述滴定实验中若滴定终点时溶液的pH=8.8,可选择
(4)滴定前读数时平视凹液面,滴定终点读数时俯视刻度线,则测量结果比实际值
(5)滴定至终点时,消耗NaOH溶液20.00mL,则该葡萄酒中SO2的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.00 mL水溶液。
②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L-1的KMnO4溶液滴定至KMnO4不再褪色为止。
所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)下列仪器中,实验中不需要的有(填序号)__________ ,还缺少的仪器有(填名称)_______________ 。
a.托盘天平(带砝码,镊子) b.滴定管c.100 mL量筒 d.100 mL容量瓶 e.烧杯 f.漏斗g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准KMnO4溶液应装在________ 式滴定管中,因为_____________________ 。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会____ (填“偏大”、“偏小”或“无影响”)。
(4)在滴定过程中若用a mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为___ mol·L-1,由此可计算x值是____ 。
①称取w g草酸晶体,配成100.00 mL水溶液。
②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L-1的KMnO4溶液滴定至KMnO4不再褪色为止。
所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)下列仪器中,实验中不需要的有(填序号)
a.托盘天平(带砝码,镊子) b.滴定管c.100 mL量筒 d.100 mL容量瓶 e.烧杯 f.漏斗g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准KMnO4溶液应装在
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会
(4)在滴定过程中若用a mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】下图是中学化学中常用于混合物的分离和提纯装置,请根据装置回答问题:
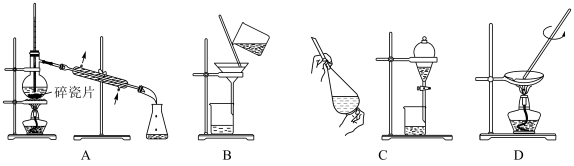
(1)A装置搭建存在不合理之处,请纠正___________ 。
(2)分离 (沸点:76.75°C)和
(沸点:76.75°C)和 (沸点:184.3°C)的互溶混合物应选用
(沸点:184.3°C)的互溶混合物应选用___________ 法(填方法名称)分离两种物质。
(3)在使用C进行化学实验操作前,应先___________ ,分液时拧动活塞,发现液体无法顺利流下,可能是因为___________ 。
工业盐是化学工业的基本原料之一,主要成分有NaCl、等,其中有毒。因工业盐外观与普通食盐无明显差异,误食会造成中毒。某同学设计如下实验方案,提纯工业盐中的NaCl。

NaCl与溶解度随温度变化曲线示意图
(4)根据所提供NaCl与 相关信息,补全合理的实验流程:取样→溶解→
相关信息,补全合理的实验流程:取样→溶解→___________ →洗涤→烘干
(5)在洗涤流程中,为验证洗涤是否充分,该同学购买了市售亚硝酸盐检测试纸,亚硝酸盐溶液可使试纸显紫红色,请具体描述验证洗涤是否充分的实验操作:___________ 。

(1)A装置搭建存在不合理之处,请纠正
(2)分离
 (沸点:76.75°C)和
(沸点:76.75°C)和 (沸点:184.3°C)的互溶混合物应选用
(沸点:184.3°C)的互溶混合物应选用(3)在使用C进行化学实验操作前,应先
工业盐是化学工业的基本原料之一,主要成分有NaCl、等,其中有毒。因工业盐外观与普通食盐无明显差异,误食会造成中毒。某同学设计如下实验方案,提纯工业盐中的NaCl。

NaCl与溶解度随温度变化曲线示意图
(4)根据所提供NaCl与
 相关信息,补全合理的实验流程:取样→溶解→
相关信息,补全合理的实验流程:取样→溶解→(5)在洗涤流程中,为验证洗涤是否充分,该同学购买了市售亚硝酸盐检测试纸,亚硝酸盐溶液可使试纸显紫红色,请具体描述验证洗涤是否充分的实验操作:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室用乳酸与异戊醇反应制备乳酸异戊酯,有关数据和装置示意图如下: +
+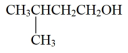
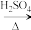
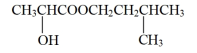 +H2O
+H2O
实验步骤:
①如图连接好装置,在A中加入9g乳酸和17.6g异戊醇、数滴浓硫酸和2~3片碎瓷片开始缓慢加热A。
②回流1h,反应液冷却至室温后,倒入分液漏斗中,先水洗,再用饱和碳酸钠溶液洗涤至中性,最后用饱和食盐水和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻。
③过滤除去硫酸镁固体,进行蒸馏纯化,收集200~203℃馏分,得乳酸异戊酯13.6g。
回答下列问题:
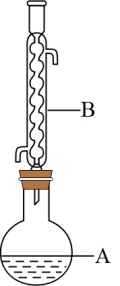
(1)图中A仪器的名称是___________ ,B仪器的作用是___________ 。
(2)在该实验中,A的容积最适合的是___________ (填入正确选项前的字母)。
A.50mL B.100mL C.150mL
(3)用饱和碳酸钠溶液洗涤的主要目的是___________ ,分离提纯过程中加入无水硫酸镁的目的是___________ 。
(4)在蒸馏纯化过程中,下列说法错误的是___________ 。
A.加热一段时间后发现忘记加瓷片,应该冷却后补加
B.温度计应该插入液面以下
C.冷却水的方向是上进下出,保证冷却水快速流动
D.蒸馏时用到的主要玻璃仪器有:酒精灯、蒸馏烧瓶、冷凝管、温度计、牛角管、锥形瓶
(5)本实验中加入过量异戊醇的目的是___________ ,本实验的产率是___________ 。
 +
+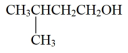
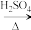
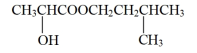 +H2O
+H2O| 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解度 | |
| 乳酸 | 90 | 1.209 | 122 | 溶 |
| 异戊醇 | 88 | 0.81 | 131 | 微溶 |
| 乳酸异戊酯 | 160 | 0.987 | 202 | 不溶 |
①如图连接好装置,在A中加入9g乳酸和17.6g异戊醇、数滴浓硫酸和2~3片碎瓷片开始缓慢加热A。
②回流1h,反应液冷却至室温后,倒入分液漏斗中,先水洗,再用饱和碳酸钠溶液洗涤至中性,最后用饱和食盐水和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻。
③过滤除去硫酸镁固体,进行蒸馏纯化,收集200~203℃馏分,得乳酸异戊酯13.6g。
回答下列问题:

(1)图中A仪器的名称是
(2)在该实验中,A的容积最适合的是
A.50mL B.100mL C.150mL
(3)用饱和碳酸钠溶液洗涤的主要目的是
(4)在蒸馏纯化过程中,下列说法错误的是
A.加热一段时间后发现忘记加瓷片,应该冷却后补加
B.温度计应该插入液面以下
C.冷却水的方向是上进下出,保证冷却水快速流动
D.蒸馏时用到的主要玻璃仪器有:酒精灯、蒸馏烧瓶、冷凝管、温度计、牛角管、锥形瓶
(5)本实验中加入过量异戊醇的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室可利用如图实验装置合成对氨基苯磺酸。实验步骤如下:
①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5 h。
③将反应液冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,过滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),过滤,收集产品,晾干。(说明:100 mL水在20℃时可溶解对氨基苯磺酸10.8 g,在100℃时可溶解66.7 g)
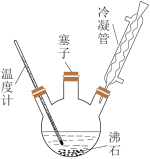
试回答下列问题。
(1)装置中冷凝管的作用是___________________ 。
(2)步骤②中采用油浴加热,下列说法正确的是__________ (填序号)。
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是______________________ 。
(4)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,过滤”的操作进行多次,其目的是_________________________________ 。
每次过滤后均应将母液收集起来,进行适当处理,其目的是__________________________________ 。
①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5 h。
③将反应液冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,过滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),过滤,收集产品,晾干。(说明:100 mL水在20℃时可溶解对氨基苯磺酸10.8 g,在100℃时可溶解66.7 g)

试回答下列问题。
(1)装置中冷凝管的作用是
(2)步骤②中采用油浴加热,下列说法正确的是
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是
(4)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,过滤”的操作进行多次,其目的是
每次过滤后均应将母液收集起来,进行适当处理,其目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】正戊醚可用作油脂、生物碱的萃取剂,Grignard反应的溶剂。以正戊醇为原料制备正戊醚的反应原理、有关数据和实验装置(夹持仪器已省略)如下:
2CH3CH2CH2CH2CH2OH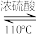 CH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3+H2O
CH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3+H2O

实验步骤:①向三颈烧瓶中加入43mL(约0.4mol)正戊醇及6mL浓硫酸,摇动使混合均匀,再加入几粒沸石。
②按示意图连接装置,向分水器中预先加少量水(略低于直管口)。维持反应约1小时。
③待反应液冷却后依次用60mL水、30mL水、20mLNaOH溶液和20mL水洗涤。
④分离出的产物加入约3g无水氯化钙颗粒,静置一段时间过滤除去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正戊醚15.8g。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶最适宜规格为_______。
(2)将实验步骤②补全:按示意图连接装置,向分水器中预先加少量水(略低于直管口)。_______ ,维持反应约1小时。
(3)装置中分水器的作用是_______ ,判断反应已经完成的标志是_______ 。
(4)洗涤粗正戊醚在_______ (填“仪器名称”)中进行;最后一次水洗的目的是_______ 。
(5)本次实验的产率为(某种生成物的实际产量与理论产量的百分比)_______ 。
2CH3CH2CH2CH2CH2OH
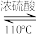 CH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3+H2O
CH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3+H2O| 名称 | 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 |
| 正戊醇 | 88 | 0.82 | 137.5 | 微溶 |
| 正戊醚 | 158 | 0.78 | 186.7 | 难溶 |

实验步骤:①向三颈烧瓶中加入43mL(约0.4mol)正戊醇及6mL浓硫酸,摇动使混合均匀,再加入几粒沸石。
②按示意图连接装置,向分水器中预先加少量水(略低于直管口)。维持反应约1小时。
③待反应液冷却后依次用60mL水、30mL水、20mLNaOH溶液和20mL水洗涤。
④分离出的产物加入约3g无水氯化钙颗粒,静置一段时间过滤除去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正戊醚15.8g。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶最适宜规格为_______。
| A.100mL | B.150mL | C.250mL | D.500mL |
(3)装置中分水器的作用是
(4)洗涤粗正戊醚在
(5)本次实验的产率为(某种生成物的实际产量与理论产量的百分比)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】葡萄糖酸锌是一种补锌剂,在医药、食品等领域应用广泛。某实验小组制备葡萄糖酸锌并测定产品中锌含量的方法如下:
步骤I:制备葡萄糖酸锌
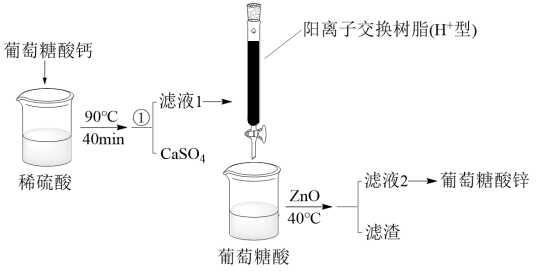
步骤II:测定产品中锌含量
准确称取mg葡萄糖酸锌产品,溶解后转移至100mL容量瓶中,加水定容。移取25.00mL溶液于锥形瓶中,加入指示剂和缓冲液,摇匀,然后用0.05mol·L-1的EDTA(呈弱酸性,用H2Y2-表示)标准溶液滴定(发生反应:Zn2++H2Y2-=ZnY2-+2H+),滴定终点时消耗VmLEDTA标准溶液。
部分物质的化学式和性质如表:
回答下列问题:
(1)葡萄糖酸( )是
)是________ (填“一元酸”“二元酸”或“多元酸”)。
(2)步骤I中,葡萄糖酸钙与稀硫酸反应的化学方程式是________ ,该反应可采取的加热方式是________ 。
(3)已知CaSO4的溶解度随温度升高而降低,故步骤I中①操作是________ ,将滤液1通过H+型阳离子交换树脂的目的是________ 。
(4)向滤液2中加入10mL95%的乙醇,充分搅拌并冷却,过滤得葡萄糖酸锌固体,加入乙醇的目的是________ 。
(5)滴定过程中,盛装EDTA标准液应选用________ (填“酸式”或“碱式”)滴定管,产品中锌含量=________ %(用含m、V的式子表示)。
步骤I:制备葡萄糖酸锌

步骤II:测定产品中锌含量
准确称取mg葡萄糖酸锌产品,溶解后转移至100mL容量瓶中,加水定容。移取25.00mL溶液于锥形瓶中,加入指示剂和缓冲液,摇匀,然后用0.05mol·L-1的EDTA(呈弱酸性,用H2Y2-表示)标准溶液滴定(发生反应:Zn2++H2Y2-=ZnY2-+2H+),滴定终点时消耗VmLEDTA标准溶液。
部分物质的化学式和性质如表:
| 名称 | 化学式 | 性质 |
| 葡萄糖酸 | C6H12O7 | 易溶于水,微溶于乙醇 |
| 葡萄糖酸钙 | Ca(C6H11O7)2 | 易溶于热水 |
| 葡萄糖酸锌 | Zn(C6H11O7)2 | 溶于水,极易溶于沸水,不溶于乙醇 |
(1)葡萄糖酸(
 )是
)是(2)步骤I中,葡萄糖酸钙与稀硫酸反应的化学方程式是
(3)已知CaSO4的溶解度随温度升高而降低,故步骤I中①操作是
(4)向滤液2中加入10mL95%的乙醇,充分搅拌并冷却,过滤得葡萄糖酸锌固体,加入乙醇的目的是
(5)滴定过程中,盛装EDTA标准液应选用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
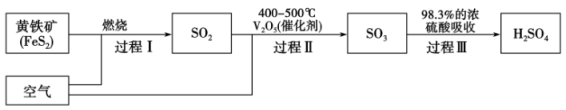
【推荐3】硫酸是十分重要的化工原料。工业上用黄铁矿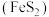 制备硫酸的工艺如图所示。
制备硫酸的工艺如图所示。
(1) 的电子式:
的电子式:_______ 。
(2)过程Ⅰ发生的化学方程式为_______ 。
(3)已知:98.3%的浓硫酸密度为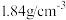 ,则该浓硫酸的物质的量浓度为
,则该浓硫酸的物质的量浓度为_______ 。
(4)实验室常用一定物质的量浓度的稀硫酸要用浓硫酸进行配制,配制过程中各操作的先后顺序是_______ 。
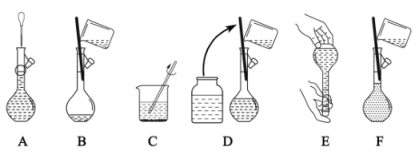
(5)如图是模拟工业探究为何采用98.3%的浓硫酸吸收三氧化硫的装置。

①图中丙和丁装置的作用分别是:_______ 。
②若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因两种是:一是丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致 从丁的水中冒了出来,与水形成酸雾;二是
从丁的水中冒了出来,与水形成酸雾;二是_______ 。
③本实验设计还存在的较明显缺陷是_______ 。
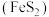 制备硫酸的工艺如图所示。
制备硫酸的工艺如图所示。
(1)
 的电子式:
的电子式:(2)过程Ⅰ发生的化学方程式为
(3)已知:98.3%的浓硫酸密度为
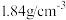 ,则该浓硫酸的物质的量浓度为
,则该浓硫酸的物质的量浓度为(4)实验室常用一定物质的量浓度的稀硫酸要用浓硫酸进行配制,配制过程中各操作的先后顺序是

(5)如图是模拟工业探究为何采用98.3%的浓硫酸吸收三氧化硫的装置。

①图中丙和丁装置的作用分别是:
②若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因两种是:一是丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致
 从丁的水中冒了出来,与水形成酸雾;二是
从丁的水中冒了出来,与水形成酸雾;二是③本实验设计还存在的较明显缺陷是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】已知软锰矿和锰结核矿的主要成分均为MnO2,二氧化锰的制备和性质在生产生活和化学实验中有广泛应用。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。
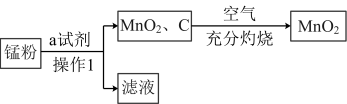
(1)某同学认为试剂a为蒸馏水,你认为______ (填“能”或“不能”)实现实验目的。
(2)操作1的名称是______ ,所用到的玻璃仪器有烧杯、玻璃棒和______ 。
(3)在空气中充分灼烧的目的是_________ 。
二氧化锰的性质检验:
Ⅰ.氧化性
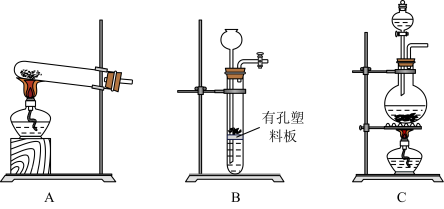
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是______ (填字母)。
(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为_______ 。
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为______ 。

Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
(7)本实验的待测数据是___________ 。
(8)由实验①和②可得出的结论是______________________ 。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。

(1)某同学认为试剂a为蒸馏水,你认为
(2)操作1的名称是
(3)在空气中充分灼烧的目的是
二氧化锰的性质检验:
Ⅰ.氧化性
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是

(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为

Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
| 实验序号 | w(H2O2)/% | 粉状MnO2/g | 温度/℃ | 待测数据 |
| ① | 5 | 0 | 20 | |
| ② | 5 | 1.0 | 20 |
(8)由实验①和②可得出的结论是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
I、用如图所示装置进行Mg与SO2反应的实验。

(1)选择制取SO2的合适试剂_______ 。
①10%的H2SO4溶液 ②70%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式_______ 。装置C中NaOH溶液的作用是_______ 。
(3)该装置仍有不足之处,请说明_______ 。
Ⅱ、某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的四条信息:
①Mg在加热的条件下即可与SiO2反应
②金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
③Si和SiO2均不与稀H2SO4反应
④SiH4在空气中自燃
他们在研究报告中记载着“…选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量…在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是_______ 。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是(用化学方程式说明):_______ 。
I、用如图所示装置进行Mg与SO2反应的实验。

(1)选择制取SO2的合适试剂
①10%的H2SO4溶液 ②70%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式
(3)该装置仍有不足之处,请说明
Ⅱ、某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的四条信息:
①Mg在加热的条件下即可与SiO2反应
②金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
③Si和SiO2均不与稀H2SO4反应
④SiH4在空气中自燃
他们在研究报告中记载着“…选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量…在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是(用化学方程式说明):
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
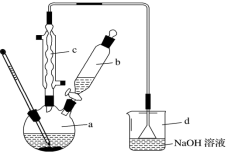
按下列合成步骤回答问题:
(1)在 a 中加入 15 mL 无水苯和少量铁屑。由 b 向 a 中加入 4 mL 液溴。烧瓶 a 中 发生反应的化学方程式是___________ 。装置 d 的作用是___________ ; 装置 c 的作用是___________ 。
(2)液溴滴完后,经过下列步骤分离提纯:
①向 a 中加入 10 mL 水,然后过滤除去未反应的铁屑;
②滤液依次用 10 mL 水、8 mL 10%的 NaOH 溶液、10 mL 水洗涤。NaOH溶液洗涤的作用是(用离子方程式表示)___________ ;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是___________ ,进一 步提纯操作方法是___________ 。
(4)若将烧杯中的 NaOH 溶液换成 AgNO3 溶液,烧杯内的现象为___________ 。

| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 难溶 | 微溶 | 难溶 |
(1)在 a 中加入 15 mL 无水苯和少量铁屑。由 b 向 a 中加入 4 mL 液溴。烧瓶 a 中 发生反应的化学方程式是
(2)液溴滴完后,经过下列步骤分离提纯:
①向 a 中加入 10 mL 水,然后过滤除去未反应的铁屑;
②滤液依次用 10 mL 水、8 mL 10%的 NaOH 溶液、10 mL 水洗涤。NaOH溶液洗涤的作用是(用离子方程式表示)
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是
(4)若将烧杯中的 NaOH 溶液换成 AgNO3 溶液,烧杯内的现象为
您最近一年使用:0次



