作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)=H2O(1)+ O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020
回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是___ 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上____ (填“放出”或“吸收”)热量____ 98kJ(填“大于”、“小于”或“等于”)。
(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起____ 作用。某组实验数据如下:
0-30minH2O2反应的平均速率v=____ mol·L-1·min-1
 O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+
 O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(H2O2)/mol·L-1 | 0.70 | 0.49 | 0.35 | 0.25 | 0.17 | 0.12 |
0-30minH2O2反应的平均速率v=
更新时间:2021-06-06 19:23:04
|
相似题推荐
【推荐1】甲烷是最简单的烃,可用来作为燃料,也是一种重要的化工原料。
(1)A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3kJ/mol
D. CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH=-445.15kJ/mol
CO2(g)+H2O(l) ΔH=-445.15kJ/mol
根据上述热化学方程式,甲烷燃烧热是___ ,H2O(l)=H2O(g)ΔH=__ kJ/mol。
(2)以水煤气为原料通过以下反应可以合成甲醇CO(g)+2H2(g) CH3OH(g)△H=-91.0kJ/mol。现将2molH2(g)和1molCO(g)充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)△H=-91.0kJ/mol。现将2molH2(g)和1molCO(g)充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①T1时增大压强,n(CH3OH)___ (填“增大”、“减小”或“不变”);T1__ T2(填“>”、“<”或“=”);
②A、B、C点对应的化学反应速率由大到小的顺序为___ 。(用v(A)、v(B)、v(C)表示);
③若B点,n(CH3OH)=0.8mol,总压强为2.5MPa,则T2温度下B点用分压强代替浓度表示的平衡常数Kp=___ 。
(3)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)

①电极X的反应材料是___ (填化学式);中间隔室b可以得到的主要物质Z是__ (填化学式)。
②电解总反应的离子方程式为__ 。
(1)A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3kJ/mol
D.
 CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH=-445.15kJ/mol
CO2(g)+H2O(l) ΔH=-445.15kJ/mol根据上述热化学方程式,甲烷燃烧热是
(2)以水煤气为原料通过以下反应可以合成甲醇CO(g)+2H2(g)
 CH3OH(g)△H=-91.0kJ/mol。现将2molH2(g)和1molCO(g)充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)△H=-91.0kJ/mol。现将2molH2(g)和1molCO(g)充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①T1时增大压强,n(CH3OH)
②A、B、C点对应的化学反应速率由大到小的顺序为
③若B点,n(CH3OH)=0.8mol,总压强为2.5MPa,则T2温度下B点用分压强代替浓度表示的平衡常数Kp=
(3)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)

①电极X的反应材料是
②电解总反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】中国力争在2030年前实现碳达峰,2060年前实现碳中和。为推动实现碳中和的愿景,探索 资源化利用前景广阔。
资源化利用前景广阔。
Ⅰ. 重整反应,可以生成合成气(CO和
重整反应,可以生成合成气(CO和 )。
)。
已知:①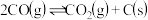
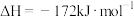
②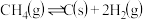
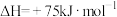
(1)催化重整反应发生的同时,还发生了积碳反应,即反应①和②。实验表明,低温、高压时会有显著积炭产生,说明此条件下积碳主要由反应___________ 产生。(填“①”或“②”)
(2)催化重整反应的热化学方程式为___________ 。
(3)该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。反应可以储能的原因是___________ 。
Ⅱ.利用光电催化反应器,实现 资源化的同时产生电能。
资源化的同时产生电能。
(4)如图所示,以 为催化剂,在光照条件下可将
为催化剂,在光照条件下可将 转化为
转化为 等有机物。生成
等有机物。生成 的过程可描述为
的过程可描述为___________ 。
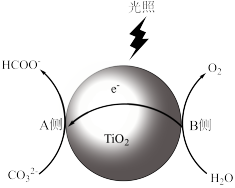
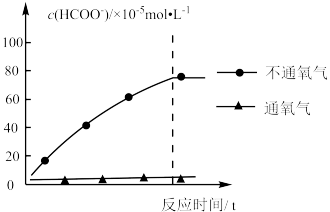
(5)以体积相同的0.25
 溶液为反应物,不同条件对生成的
溶液为反应物,不同条件对生成的 浓度影响如图所示。相同时间内溶液中通入氧气时
浓度影响如图所示。相同时间内溶液中通入氧气时 浓度明显低于不通氧气时,可能的原因是
浓度明显低于不通氧气时,可能的原因是___________ 。
 资源化利用前景广阔。
资源化利用前景广阔。Ⅰ.
 重整反应,可以生成合成气(CO和
重整反应,可以生成合成气(CO和 )。
)。已知:①
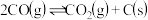
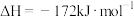
②
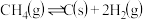
(1)催化重整反应发生的同时,还发生了积碳反应,即反应①和②。实验表明,低温、高压时会有显著积炭产生,说明此条件下积碳主要由反应
(2)催化重整反应的热化学方程式为
(3)该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。反应可以储能的原因是
Ⅱ.利用光电催化反应器,实现
 资源化的同时产生电能。
资源化的同时产生电能。(4)如图所示,以
 为催化剂,在光照条件下可将
为催化剂,在光照条件下可将 转化为
转化为 等有机物。生成
等有机物。生成 的过程可描述为
的过程可描述为
(5)以体积相同的0.25

 溶液为反应物,不同条件对生成的
溶液为反应物,不同条件对生成的 浓度影响如图所示。相同时间内溶液中通入氧气时
浓度影响如图所示。相同时间内溶液中通入氧气时 浓度明显低于不通氧气时,可能的原因是
浓度明显低于不通氧气时,可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】碳排放是2020年世界重点议题,回答下列问题。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ·mo1-1;
2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ·mo1-1;
HCOOH(1)=CO(g)+H2O(g) ΔH3=+72.6kJ·mo1-1;
较高温度下,CO2(g)+H2(g)=HCOOH(1)正反应不能自发进行的原因___________ 。
(2)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
则CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=___________ kJ·mo1-1。
(3)CO2(g)+H2(g)=CO(g)+H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图。
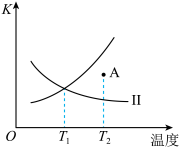
①表示K正曲线的是___________ (填“I”或“II”)。
②T1时,向体积为10L的固定容积的容器中充入2molCO2、2molH2,CO2的平衡转化率为___________ 。
③T2时,A点v正___________ (填“>”“=”或“<”)v逆。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ·mo1-1;
2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ·mo1-1;
HCOOH(1)=CO(g)+H2O(g) ΔH3=+72.6kJ·mo1-1;
较高温度下,CO2(g)+H2(g)=HCOOH(1)正反应不能自发进行的原因
(2)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
| 化学键 | H-O | C≡O | C=O | H-H |
| E/(kJ/mol) | 463 | 1075 | 803 | 436 |
(3)CO2(g)+H2(g)=CO(g)+H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图。

①表示K正曲线的是
②T1时,向体积为10L的固定容积的容器中充入2molCO2、2molH2,CO2的平衡转化率为
③T2时,A点v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】氨是化肥工业和基本有机化工的重要原料,合成氨反应是化学上最重要的反应之一

(1)N2和H2在常温常压下反应极慢,为提高合成氨反应的速率,工业上除采取增大压强以提高浓度外,还可采取的措施是____________ (答一条即可)
(2)已知反应N2(g)+3H2(g) 2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示
2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示
①图a中N点对应的时间是图b中的____________ (填“t1”“t2”或“t3”)
②图b中,0~t1内平均速率v正(N2)=mol•L-1•min-1,则t1~t2内平均速率v正(N2)应____________ (填标号)mol•L-1•min-1
A.大于uB.等于uC.小于u
(3)往恒温恒容密闭容器中通入1molN2和3molH2,充分反应后,测得压强为起始时压强的75%,N2的转化率为____________ 。
(4)某兴趣小组同学设计了如图所示装置模拟工业上合成氨。

①流经橡胶管处的气体成分为____________ (填化学式)
②能说明有氨生成的现象是____________ 。

(1)N2和H2在常温常压下反应极慢,为提高合成氨反应的速率,工业上除采取增大压强以提高浓度外,还可采取的措施是
(2)已知反应N2(g)+3H2(g)
 2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示
2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示①图a中N点对应的时间是图b中的
②图b中,0~t1内平均速率v正(N2)=mol•L-1•min-1,则t1~t2内平均速率v正(N2)应
A.大于uB.等于uC.小于u
(3)往恒温恒容密闭容器中通入1molN2和3molH2,充分反应后,测得压强为起始时压强的75%,N2的转化率为
(4)某兴趣小组同学设计了如图所示装置模拟工业上合成氨。

①流经橡胶管处的气体成分为
②能说明有氨生成的现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】在一定温度下,发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
(1)该反应的平衡常数表达式K=___________ ,ΔH___________ (填“<”“>”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求10 min时c(CO)=___________ mol·L-1,CO2的物质的量为___________ mol,该时间范围内反应的平均反应速率v(CO2)=___________ ,CO的平衡转化率为___________ 。
(3)判断该反应是否达到平衡的依据为___________ (填字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.CO2的浓度不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
(4)1000℃反应2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)的平衡常数值为
Fe2O3(s)+3CO(g)的平衡常数值为___________ 。
(5)1000 ℃时,在(2)的平衡体系中,各加0.5 mol CO和0.5 mol CO2,v正___________ (填“<”“>”或“=”)v逆,平衡___________ (填“正向”“逆向”或“不”)移动。
 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
(1)该反应的平衡常数表达式K=
(2)在一个容积为10 L的密闭容器中,1000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求10 min时c(CO)=
(3)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.CO2的浓度不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
(4)1000℃反应2Fe(s)+3CO2(g)
 Fe2O3(s)+3CO(g)的平衡常数值为
Fe2O3(s)+3CO(g)的平衡常数值为(5)1000 ℃时,在(2)的平衡体系中,各加0.5 mol CO和0.5 mol CO2,v正
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某课外兴趣小组实验探究影响化学反应速率的因素。
I.硫代硫酸钠( )俗称大苏打、海波,广泛应用于照相定影等领域。乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
)俗称大苏打、海波,广泛应用于照相定影等领域。乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
(1)硫代硫酸钠与稀硫酸生成淡黄色沉淀和刺激性气味气体,写出该反应的化学方程式_____ 。
(2)该实验1和2可探究_______ 对反应速率的影响。
(3)实验1和3可探究硫酸浓度对反应速率的影响,因此
_______ 。
(4)上述实验中溶液最先变浑浊的是_______ (填实验编号)。
Ⅱ.为更精确地研究浓度对反应速率的影响,小组同学利用压强传感器等数字化实验设备,探究镁与不同浓度硫酸的反应速率,两组实验所用药品如表:
实验结果如图所示:

(5)实验1对应图中曲线_______ (填字母)。
(6)分析实验2对应曲线可知,反应开始阶段,反应速率不断加快,原因是:______ 。
(7)如果用2mL 1.0mol/L HCl代替实验1中的硫酸,与实验1相比较,二者的反应速率_______ “相同”、“不相同”或“无法比较”)。请说明原因:_______ 。
I.硫代硫酸钠(
 )俗称大苏打、海波,广泛应用于照相定影等领域。乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
)俗称大苏打、海波,广泛应用于照相定影等领域。乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:| 实验序号 | 反应温度/℃ |  浓度 浓度 | 稀硫酸 |  | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| 1 | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| 2 | 40 |  | 0.10 |  | 0.50 | 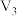 |
| 3 | 20 | 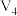 | 0.10 | 4.0 | 0.50 | 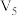 |
(2)该实验1和2可探究
(3)实验1和3可探究硫酸浓度对反应速率的影响,因此
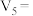
(4)上述实验中溶液最先变浑浊的是
Ⅱ.为更精确地研究浓度对反应速率的影响,小组同学利用压强传感器等数字化实验设备,探究镁与不同浓度硫酸的反应速率,两组实验所用药品如表:
| 序号 | 镁条的质量/g | 硫酸 | |
| 物质的量浓度(mol/L) | 体积/mL | ||
| 1 | 0.01 | 1.0 | 2 |
| 2 | 0.01 | 0.5 | 2 |

(5)实验1对应图中曲线
(6)分析实验2对应曲线可知,反应开始阶段,反应速率不断加快,原因是:
(7)如果用2mL 1.0mol/L HCl代替实验1中的硫酸,与实验1相比较,二者的反应速率
您最近一年使用:0次



