碘是人体必需的微量元素,幼儿缺碘可导致发育迟缓、呆傻等多种疾病。海带中含有较多的碘元素,以下是从海带中提取碘并测定碘含量的实验方案。
提示:海带灰中碘元素以 形式存在。
形式存在。
实验一:海带中碘元素的检验
步骤Ⅰ:准确称取20.0g干海带,去除表面附着物、洗净、剪碎,用酒精浸润,灼烧完全至灰烬,停止加热、冷却。
步骤Ⅱ:将海带灰全部转移到小烧杯中,加入 蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至
蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至 容量瓶中定容。
容量瓶中定容。
步骤Ⅲ:取步骤IⅡ容量瓶中的溶液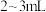 于试管中,加入几滴
于试管中,加入几滴
 溶液酸化,再加入
溶液酸化,再加入 3%的
3%的 溶液和几滴淀粉溶液,观察现象。
溶液和几滴淀粉溶液,观察现象。
实验二:海带中碘元素含量的测定
步骤Ⅳ:取步骤Ⅱ容量瓶中溶液 于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入
于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入 10%
10% 溶液,摇匀,立即用
溶液,摇匀,立即用 的
的 标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗
标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗 标准溶液
标准溶液 。
。
涉及的有关反应有:①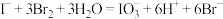
②
③
请按要求完成下列问题:
(1)步骤Ⅰ中用酒精浸润海带的作用是_______ ,灼烧海带的实验中需要的实验仪器有酒精灯、铁架台、泥三角、玻璃棒和_______ (填仪器名称)。
(2)说明海带中有碘元素的实验现象是_______ ,写出步骤中发生的离子反应方程式_______ 。
(3)根据以上数据计算每千克海带中含碘量约为_______  。
。
提示:海带灰中碘元素以
 形式存在。
形式存在。实验一:海带中碘元素的检验
步骤Ⅰ:准确称取20.0g干海带,去除表面附着物、洗净、剪碎,用酒精浸润,灼烧完全至灰烬,停止加热、冷却。
步骤Ⅱ:将海带灰全部转移到小烧杯中,加入
 蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至
蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至 容量瓶中定容。
容量瓶中定容。步骤Ⅲ:取步骤IⅡ容量瓶中的溶液
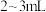 于试管中,加入几滴
于试管中,加入几滴
 溶液酸化,再加入
溶液酸化,再加入 3%的
3%的 溶液和几滴淀粉溶液,观察现象。
溶液和几滴淀粉溶液,观察现象。实验二:海带中碘元素含量的测定
步骤Ⅳ:取步骤Ⅱ容量瓶中溶液
 于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入
于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入 10%
10% 溶液,摇匀,立即用
溶液,摇匀,立即用 的
的 标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗
标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗 标准溶液
标准溶液 。
。涉及的有关反应有:①
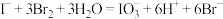
②

③

请按要求完成下列问题:
(1)步骤Ⅰ中用酒精浸润海带的作用是
(2)说明海带中有碘元素的实验现象是
(3)根据以上数据计算每千克海带中含碘量约为
 。
。
更新时间:2021/06/25 09:04:20
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。某学生用如图所示实验装置,完成还原铁粉与水蒸气反应的实验。
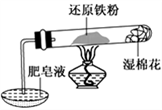
(1)实验中使用肥皂液的作用是____________ 。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行 了下列实验:
根据上述实验,能确定固体中存在的物质有:______________________________ ;不能确定是否存在Fe3O4的原因是:___________________________________________ 。
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。
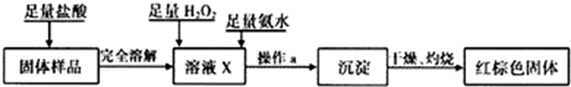
①溶液X中发生氧化还原反应的离子方程式为___________ ;
②操作a为_______ ,检验沉淀是否已经洗涤干净的操作是___________________ 。
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08 g溶于足量盐酸中,向所得溶液中通入448 mLCl2(标准状况),恰好将Fe2+完全氧化。则x=__________ 。

(1)实验中使用肥皂液的作用是
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行 了下列实验:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。

①溶液X中发生氧化还原反应的离子方程式为
②操作a为
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08 g溶于足量盐酸中,向所得溶液中通入448 mLCl2(标准状况),恰好将Fe2+完全氧化。则x=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某种胃药的有效成分为碳酸钙,测定此胃药中碳酸钙含量的操作如下(该药中其他成分不参与反应):
①配制0.10mol/L稀盐酸和0.10mol/L NaOH溶液
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水
③用0.10mol/L NaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积
④加入25.00mL 0.10mol/L稀盐酸
请回答下列问题
(1)正确测量碳酸钙含量的操作顺序是___________。
(2)上面操作中碳酸钙发生反应的离子方程式为___________ 。
(3)某同学4次测定所消耗NaOH溶液的体积如下,则在第①步配制稀盐酸溶液操作时选用容量瓶最合适的规格是___________ (实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶)。
按上表中实验数据,计算上述胃药中碳酸钙的质量分数___________ 。
①配制0.10mol/L稀盐酸和0.10mol/L NaOH溶液
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水
③用0.10mol/L NaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积
④加入25.00mL 0.10mol/L稀盐酸
请回答下列问题
(1)正确测量碳酸钙含量的操作顺序是___________。
| A.①②③④ | B.①②④③ | C.②①④③ | D.①④③② |
(3)某同学4次测定所消耗NaOH溶液的体积如下,则在第①步配制稀盐酸溶液操作时选用容量瓶最合适的规格是
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(NaOH)/mL | 13.00 | 12.90 | 13.10 | 13.80 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】高锰酸钾(KMnO4)是生活中常见的消毒剂和中学重要的氧化剂,也是高锰酸钾溶液滴定实验中的指示剂。
实验(一)探究影响反应速率的因素。
(1)为了探究浓度对反应速率的影响并利用KMnO4颜色褪去所需时间表征速率,设计如下实验方案:
利用实验_______ (填代号)可以得出“其他条件相同时,浓度越大,化学反应速率越快”的规律。
(2)探究催化剂对反应速率的影响。在5.0 mL0.1 mol·L-1KMnO4溶液中加入15 mL0.1 mol·L-1H2C2O4溶液和5 mL0.1 mol·L-1H2SO4溶液,测得产生CO2体积与时间关系如图所示(假设CO2全部逸出)。_______ 。
②针对AB段反应速率变快的原因提出如下猜想:
猜想1:温度升高;
猜想2:_______ 。
③设计实验验证猜想2,实验如下表所示
供选试剂:MnCl2粉末、Mn(NO3)2粉末、MnSO4粉末。V=_______ ;X是_______ (填化学式)。
(3)KMnO4是常用的滴定剂。双氧水是日常生活中常用的消毒剂,广泛应用于皮肤消毒,它也是工业生产中的绿色氧化剂。常用氧化还原滴定法测定双氧水溶液浓度,取20.00 mL双氧水溶液样品稀释成250 mL溶液,准确量取25.00 mL稀释后溶液于锥形瓶,滴加适量稀硫酸,用c mol·L-1KMnO4标准溶液滴定,三次平行实验测得消耗滴定液为20.00 mL。
①选择如图所示滴定管_______ (填“A"或“B")。_______ 。
③该双氧水溶液的物质的量浓度为_______ mol·L-1。
④滴定操作太慢,测定结果可能偏低,其主要原因可能有_______ (写出1条即可)。
实验(一)探究影响反应速率的因素。
(1)为了探究浓度对反应速率的影响并利用KMnO4颜色褪去所需时间表征速率,设计如下实验方案:
| 实验 | 0.1 mol·L-1KMnO4 溶液/mL | 0.1 mol·L-1H2C2O4溶液/mL | 0.1 mol·L-1H2SO4 溶液/mL | 蒸馏水 /mL |
| 甲 | 5.0 | 15.0 | 5.0 | 0 |
| 乙 | 5.0 | 10.0 | 5.0 | 5.0 |
| 丙 | 10.0 | 10.0 | 5.0 | 0 |
(2)探究催化剂对反应速率的影响。在5.0 mL0.1 mol·L-1KMnO4溶液中加入15 mL0.1 mol·L-1H2C2O4溶液和5 mL0.1 mol·L-1H2SO4溶液,测得产生CO2体积与时间关系如图所示(假设CO2全部逸出)。
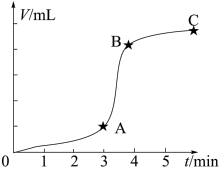
②针对AB段反应速率变快的原因提出如下猜想:
猜想1:温度升高;
猜想2:
③设计实验验证猜想2,实验如下表所示
| 实验 | 0.1 mol·L-1KMnO4溶液/mL | 0.1 mol·L-1H2C2O4溶液/mL | 0.1 mol·L-1H2SO4溶液/mL | 外加物质 |
| 丁 | 5.0 | 10.0 | 5.0 | 0 |
| 戊 | 5.0 | V | 5.0 | 1 gX |
(3)KMnO4是常用的滴定剂。双氧水是日常生活中常用的消毒剂,广泛应用于皮肤消毒,它也是工业生产中的绿色氧化剂。常用氧化还原滴定法测定双氧水溶液浓度,取20.00 mL双氧水溶液样品稀释成250 mL溶液,准确量取25.00 mL稀释后溶液于锥形瓶,滴加适量稀硫酸,用c mol·L-1KMnO4标准溶液滴定,三次平行实验测得消耗滴定液为20.00 mL。
①选择如图所示滴定管

③该双氧水溶液的物质的量浓度为
④滴定操作太慢,测定结果可能偏低,其主要原因可能有
您最近一年使用:0次
【推荐1】开发和利用海洋资源是当前科学研究的一项重要任务,如图是某化工厂对海洋资源综合利用的流程图:
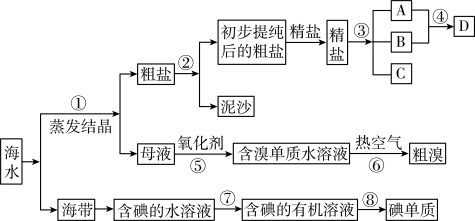
请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:_______ 。
(2)初步提纯后的粗盐中含有Ca2+、Mg2+、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:

加入的试剂①、②分别是:_______ 、_______ 。
(3)步骤③的条件是通直流电,其离子方程式为_______ 。D具有杀菌消毒的作用,在喷洒前需要在空气中晾置一会,这样做的原因是_______ 。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克Cl2的氧化能力(氯元素均被还原至-1价)。则亚氯酸钠NaClO2的有效氯含量为_______ (保留两位小数)。
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是_______ 。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______ 性。对粗溴一般做如下处理:
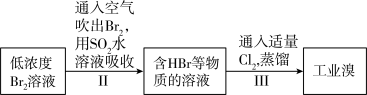
其中步骤Ⅱ、Ⅲ起到的作用是_______ 。
向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应。
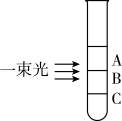
(7)写出制备氯化银胶体的方程式:_______ 。
(8)具有明显的丁达尔效应的是区域_______ (填字母),该区域中分散质的粒径大小为_______ 。
(9)分离出C区域的分散质的方法是_______ 。

请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:
(2)初步提纯后的粗盐中含有Ca2+、Mg2+、
 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
加入的试剂①、②分别是:
(3)步骤③的条件是通直流电,其离子方程式为
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克Cl2的氧化能力(氯元素均被还原至-1价)。则亚氯酸钠NaClO2的有效氯含量为
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有

其中步骤Ⅱ、Ⅲ起到的作用是
向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应。

(7)写出制备氯化银胶体的方程式:
(8)具有明显的丁达尔效应的是区域
(9)分离出C区域的分散质的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
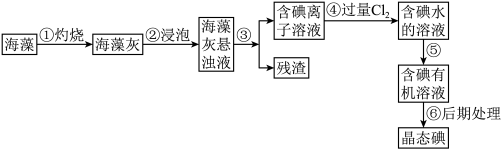
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________ (填字母)。
A 烧杯 B 坩埚 C 表面皿 D 泥三角 E 酒精灯 F 干燥器
(2)步骤③的实验操作名称是____________ ,步骤⑤的操作名称是________ 。
(3)步骤④反应的离子方程式为_________________________________ 。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:______________________ 。

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A 烧杯 B 坩埚 C 表面皿 D 泥三角 E 酒精灯 F 干燥器
(2)步骤③的实验操作名称是
(3)步骤④反应的离子方程式为
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)在标准状况下,有下列物质①4gH2,②33.6LCH4,③1molH2O,④3.01×1023个O2.其中含分子数最多的是(填序号,下同)___________ ,质量最大的是___________ ,体积最小的___________ ;密度由大到小的顺序为___________ 。
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:

已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。
I.提取碘的过程中有关的实验操作名称:③___________ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号)___________ ,还缺少的玻璃仪器有___________ 。
III.提取碘的过程中,选用的萃取剂可以是___________ 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:

已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。
I.提取碘的过程中有关的实验操作名称:③
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号)
III.提取碘的过程中,选用的萃取剂可以是
A.四氯化碳 B.汽油 C.酒精 D.醋酸
您最近一年使用:0次



