硼的总浓度≥0.4mol·L-1的硼酸及其盐的水溶液中不仅存在四硼酸根离子
B4O5(OH) ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。
(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)_______ 。
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式_______ 。
注:以B4O5(OH) 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。

B4O5(OH)
 ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式
注:以B4O5(OH)
 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
更新时间:2021-07-05 18:49:27
|
相似题推荐
填空题
|
较难
(0.4)
解题方法
【推荐1】离子液体是一种只由离子组成的液体,在低温下也能以液态稳定存在,是一种很有研究价值的溶剂。对离子液体的研究显示最常见的离子液体主要由以下的正离子和负离子组成:
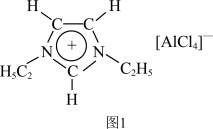
回答下列问题:
(1)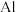 在周期表中的位置是
在周期表中的位置是______ ,其价电子排布式为______ 图 1中负离子的空间构型为______ 。
(2)氯化铝的熔点为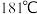 ,氮化铝的熔点高达
,氮化铝的熔点高达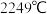 ,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是
,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是______ 。
(3)图中正离子有令人惊奇的稳定性,它的电子在其环状结构中高度离域。该正离子中N原子的杂化方式为______ ,C 原子的杂化方式为______ 。
(4)为了使正离子以单体形式存在以获得良好的溶解性能,与N原子相连的 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:______ 。
(5)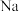 、Mg、Al三种元素的第一电离能由大到小的顺序是
、Mg、Al三种元素的第一电离能由大到小的顺序是______ 。
(6)已知氮化铝的晶胞结构如图2所示。晶体中氮原子堆积方式如图3所示,这种堆积方式称为______ 。 六棱柱底边边长为acm,高为c cm,阿伏加 德罗常数的值为N,氮化铝晶体的密度为______ 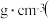 列出计算式
列出计算式 。
。


回答下列问题:
(1)
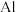 在周期表中的位置是
在周期表中的位置是(2)氯化铝的熔点为
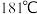 ,氮化铝的熔点高达
,氮化铝的熔点高达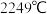 ,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是
,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是(3)图中正离子有令人惊奇的稳定性,它的电子在其环状结构中高度离域。该正离子中N原子的杂化方式为
(4)为了使正离子以单体形式存在以获得良好的溶解性能,与N原子相连的
 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:(5)
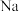 、Mg、Al三种元素的第一电离能由大到小的顺序是
、Mg、Al三种元素的第一电离能由大到小的顺序是(6)已知氮化铝的晶胞结构如图2所示。晶体中氮原子堆积方式如图3所示,这种堆积方式称为
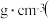 列出计算式
列出计算式 。
。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】回答下列问题:
(1)原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为______ 。
(2)某同学画的基态Be原子电子排布图 ,分析其违背了什么原理:
,分析其违背了什么原理:______ 。
(3)橄榄石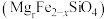 中各元素电负性由大到小顺序为:
中各元素电负性由大到小顺序为:______ 。
(4) 的沸点为
的沸点为 的沸点为
的沸点为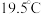 ,试从氢键角度解释这一现象:
,试从氢键角度解释这一现象:______ 。
(5)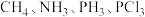 键角由大到小的顺序为:
键角由大到小的顺序为:______ 。
(6)碱金属熔点如下表
试用金属键相关理论解释该递变现象:______ 。
(7)往 溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是
溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是______ 。
(1)原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为(2)某同学画的基态Be原子电子排布图
 ,分析其违背了什么原理:
,分析其违背了什么原理:(3)橄榄石
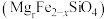 中各元素电负性由大到小顺序为:
中各元素电负性由大到小顺序为:(4)
 的沸点为
的沸点为 的沸点为
的沸点为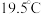 ,试从氢键角度解释这一现象:
,试从氢键角度解释这一现象:(5)
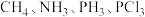 键角由大到小的顺序为:
键角由大到小的顺序为:(6)碱金属熔点如下表
| 碱金属 |  |  |  | 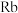 |  |
| 熔点/℃ | 180.5 | 97.8 | 63.6 | 38.9 | 28.4 |
(7)往
 溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是
溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________ 。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____ ;C、N、O的第一电离能由大到小的顺序为_____________ 。
(3)N的氢化物常作制冷剂,原因是______________ 。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______ 形。其中硫原子采用_________ 杂化,写出SO42-的一种等电子体的化学式:______ 。
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________ 。Ti4+和周围_____ 个O2-相紧邻。该晶胞的边长为apm,则其密度为______ g/cm3。
(1)Ti基态原子的电子排布式为
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为
(3)N的氢化物常作制冷剂,原因是
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为

您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显___________ 价,A的电负性___________ B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长λ与光的频率v的关系为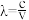 ,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量___________ kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:___________ 。
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是___________ 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有___________ 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________ 。
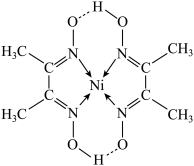
(5)某配合物的分子结构如图所示,其分子内不含有___________ (填字母)。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长λ与光的频率v的关系为
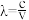 ,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(5)某配合物的分子结构如图所示,其分子内不含有___________ (填字母)。

| A.离子键 | B.共价键 | C.配位键 | D.氢键 |
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)Ti(H2O) 中∠H-O-H
中∠H-O-H_____ (填“大于”、“小于”或“等于”)单个水分子中∠H-O-H;Ti(NO3)4的球棍结构如图,Ti的配位数是_____ 。

(2)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

则TiO2-aNb晶体中a=_____ 。已知原子1、2的分数坐标为(0,0, )和(1,0,0),则原子3的坐标分别为
)和(1,0,0),则原子3的坐标分别为_____ ,设阿伏加德罗常数的值为NA,TiO2的密度为_____ g•cm-3 (列出计算式)。
(1)Ti(H2O)
 中∠H-O-H
中∠H-O-H
(2)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

则TiO2-aNb晶体中a=
 )和(1,0,0),则原子3的坐标分别为
)和(1,0,0),则原子3的坐标分别为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】选考【化学——选修3:物质结构与性质】四种常见元素的性质或结构信息如F表所示,请问答下列问题。
(1)R的基态原子价层电子排布式为________ ,这四种元素的第一电离能由大到小的顺序为________________ (写元素符号)。
(2)
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中 键之比为
键之比为________ ,已知有下列两种数据:
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________ 。
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________ 。

(5)A元素能形成组成为Pt(AH3)2Cl2的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________ (填“极性”或“非极性”)分子,
②P的结构简式为________ (AH3配体作为一个整体写)。
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3 个能级且最高能级上有3 个电子 | B的单质是最常 见半导体材料 | 位于第四周期 IB族 | 是非金属元素,其形成的 某种单质是电的良导体, 有的分子形状似足球 |
(2)
| A.B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______,任意写出一种中心原子存在sp3、sp2两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。 |
 键之比为
键之比为| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615 D-O:348 | 216 | 195 |
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为

(5)A元素能形成组成为Pt(AH3)2Cl2的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是
②P的结构简式为
您最近一年使用:0次



