回答下列问题:
(1)原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为______ 。
(2)某同学画的基态Be原子电子排布图 ,分析其违背了什么原理:
,分析其违背了什么原理:______ 。
(3)橄榄石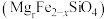 中各元素电负性由大到小顺序为:
中各元素电负性由大到小顺序为:______ 。
(4) 的沸点为
的沸点为 的沸点为
的沸点为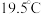 ,试从氢键角度解释这一现象:
,试从氢键角度解释这一现象:______ 。
(5)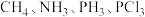 键角由大到小的顺序为:
键角由大到小的顺序为:______ 。
(6)碱金属熔点如下表
试用金属键相关理论解释该递变现象:______ 。
(7)往 溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是
溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是______ 。
(1)原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则
表示,称为电子的自旋磁量子数,则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为(2)某同学画的基态Be原子电子排布图
 ,分析其违背了什么原理:
,分析其违背了什么原理:(3)橄榄石
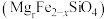 中各元素电负性由大到小顺序为:
中各元素电负性由大到小顺序为:(4)
 的沸点为
的沸点为 的沸点为
的沸点为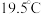 ,试从氢键角度解释这一现象:
,试从氢键角度解释这一现象:(5)
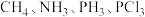 键角由大到小的顺序为:
键角由大到小的顺序为:(6)碱金属熔点如下表
| 碱金属 |  |  |  | 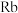 |  |
| 熔点/℃ | 180.5 | 97.8 | 63.6 | 38.9 | 28.4 |
(7)往
 溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是
溶液中逐滴加入氨水,直到生成的沉淀恰好溶解,得到深蓝色溶液,再加入乙醇后,析出深蓝色晶体。加乙醇的作用是
更新时间:2024-03-24 08:27:50
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为______ 。氧元素与氟元素能形成OF2分子,该分子的空间构型为______ 。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是______ ;1 mol O22+中含有的π键数目为______ 个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为______ 。

(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为______ 。
(5)下列物质的分子与O3分子的结构最相似的是______ 。
A.H2O B.CO2 C.SO2 D.BeCl2
(6)O3分子是否为极性分子?______ 。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为

(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为
(5)下列物质的分子与O3分子的结构最相似的是
A.H2O B.CO2 C.SO2 D.BeCl2
(6)O3分子是否为极性分子?
您最近一年使用:0次
【推荐2】不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳(C)原子的核外电子排布图为___________ 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为___________ 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子外围电子排布式为_____ 。
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A~D图中正确的是_____ 。

(5)据报道,只含镁、镍和碳三种元素的晶体具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的晶胞结构如图所示,试写出该晶体的化学式:___________ 。晶体中每个镁原子周围距离最近的镍原子有___________ 个。

(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列问题。
①在周期表中,最可能处于同一族的是___________ 和___________ 。
②T元素最可能是___________ 区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成的化合物的空间构型为___________ ,其中心原子的杂化方式为___________ 。
(1)基态碳(C)原子的核外电子排布图为
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子外围电子排布式为
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A~D图中正确的是

(5)据报道,只含镁、镍和碳三种元素的晶体具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的晶胞结构如图所示,试写出该晶体的化学式:

(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列问题。
元素代号 | I1 | I2 | I3 | I4 |
Q | 2 080 | 4 000 | 6 100 | 9 400 |
R | 500 | 4 600 | 6 900 | 9 500 |
S | 740 | 1 500 | 7 700 | 10 500 |
T | 580 | 1 800 | 2 700 | 11 600 |
U | 420 | 3 100 | 4 400 | 5 900 |
①在周期表中,最可能处于同一族的是
②T元素最可能是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____ ,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________ 。硫所在周期中,第一电离能最大的元素是___________ 。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________ 。
(3)H2S中S原子的杂化类型是__________ ;H2S的VSEPR模型名称为_________ ;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________ 。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________ 个配位键,___________ 个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________ 。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____ 个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____ cm。
(1)当基态原子的电子吸收能量后,电子会发生
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式
(3)H2S中S原子的杂化类型是
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。元素W比元素X序数小5。
(1)X与Y所形成化合物晶体的晶胞如下图所示。
①在1个晶胞中,X离子的数目为_____________ 。
②该化合物的化学式为_______________ 。
③写出元素W的价电子排布式______________ 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是__________ 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_____________ 。
(4)Y与Z可形成YZ42-,YZ42-的空间构型为__________ (用文字描述)。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该配合物的1个配体中含有σ键的数目为_______ 。
(1)X与Y所形成化合物晶体的晶胞如下图所示。
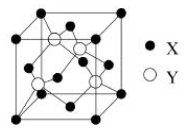
①在1个晶胞中,X离子的数目为
②该化合物的化学式为
③写出元素W的价电子排布式
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
(4)Y与Z可形成YZ42-,YZ42-的空间构型为
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该配合物的1个配体中含有σ键的数目为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】 、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:
(1)基态Co原子的价电子排布式为_______________ 。
(2)Co(Ⅲ)可形成多种配合物,如图所示是 结构,
结构, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则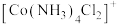 的空间结构有
的空间结构有_______________ 种。

(3) 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。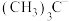 的空间结构为
的空间结构为_______________ ;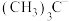 、
、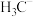 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是_______________ 。
(4)①正极材料 的晶胞结构如图(a)(Li位于晶胞顶点和内部,部分O位于晶胞之外),每个晶胞中含有个O;充电时,
的晶胞结构如图(a)(Li位于晶胞顶点和内部,部分O位于晶胞之外),每个晶胞中含有个O;充电时, 脱出部分
脱出部分 ,形成
,形成 ,结构如图(b),则
,结构如图(b),则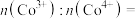
_______________ 。

②负极材料 晶胞结构如图(c),Li原子插入石墨层中间,若该晶胞中碳碳键键长为a pm,石墨层间距为d pm,阿伏加德罗常数的值为
晶胞结构如图(c),Li原子插入石墨层中间,若该晶胞中碳碳键键长为a pm,石墨层间距为d pm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______________  (列出计算式)。
(列出计算式)。

 、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:(1)基态Co原子的价电子排布式为
(2)Co(Ⅲ)可形成多种配合物,如图所示是
 结构,
结构, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则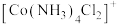 的空间结构有
的空间结构有
(3)
 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。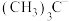 的空间结构为
的空间结构为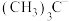 、
、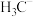 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是(4)①正极材料
 的晶胞结构如图(a)(Li位于晶胞顶点和内部,部分O位于晶胞之外),每个晶胞中含有个O;充电时,
的晶胞结构如图(a)(Li位于晶胞顶点和内部,部分O位于晶胞之外),每个晶胞中含有个O;充电时, 脱出部分
脱出部分 ,形成
,形成 ,结构如图(b),则
,结构如图(b),则

②负极材料
 晶胞结构如图(c),Li原子插入石墨层中间,若该晶胞中碳碳键键长为a pm,石墨层间距为d pm,阿伏加德罗常数的值为
晶胞结构如图(c),Li原子插入石墨层中间,若该晶胞中碳碳键键长为a pm,石墨层间距为d pm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】三磷酸腺苷(ATP)和活性氧类(如H2O2和O )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素是___________ ,基态N原子的电子排布图为___________ 。
(2)H2O2分子的氧原子的杂化轨道类型为:___________ ;H2O2和H2O能以任意比例互溶的原因是___________ 。(回答两点原因)
(3)O3分子的立体构型为___________ 。根据表中数据判断氧原子之间的共价键最稳定的粒子是___________ 。
(4)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。___________ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为___________ 。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素是
(2)H2O2分子的氧原子的杂化轨道类型为:
(3)O3分子的立体构型为
| 粒子 | O2 | O2- | O3 |
| 键长/pm | 121 | 126 | 128 |
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有关于炼锌技术的记载。回答下列问题
(1)硫酸锌溶于过量的氨水可形成配合物[Zn(NH3)4]SO4。
①配合物[Zn(NH3)4]SO4中,[Zn(NH3)4]2+的名称是____________ 。
② 中,中心原子的轨道杂化类型为
中,中心原子的轨道杂化类型为____________ 。
③NH3极易溶于水,除了因为它们都是极性分子外还因为____________ 。
(2)Zn2+的4s和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间构型为____________ 。
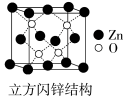
(3)氧化锌的结构有多种,其中一种立方闪锌矿的结构如图所示,若该晶胞的边长为anm,NA为阿伏加 德罗常数的值则立方闪锌矿晶体的密度为____________ g•cm-3。
(1)硫酸锌溶于过量的氨水可形成配合物[Zn(NH3)4]SO4。
①配合物[Zn(NH3)4]SO4中,[Zn(NH3)4]2+的名称是
②
 中,中心原子的轨道杂化类型为
中,中心原子的轨道杂化类型为③NH3极易溶于水,除了因为它们都是极性分子外还因为
(2)Zn2+的4s和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间构型为
(3)氧化锌的结构有多种,其中一种立方闪锌矿的结构如图所示,若该晶胞的边长为anm,NA为阿伏加 德罗常数的值则立方闪锌矿晶体的密度为

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。元素W比元素X序数小5。
(1)X与Y所形成化合物晶体的晶胞如下图所示。
①在1个晶胞中,X离子的数目为_____________ 。
②该化合物的化学式为_______________ 。
③写出元素W的价电子排布式______________ 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是__________ 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_____________ 。
(4)Y与Z可形成YZ42-,YZ42-的空间构型为__________ (用文字描述)。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该配合物的1个配体中含有σ键的数目为_______ 。
(1)X与Y所形成化合物晶体的晶胞如下图所示。

①在1个晶胞中,X离子的数目为
②该化合物的化学式为
③写出元素W的价电子排布式
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
(4)Y与Z可形成YZ42-,YZ42-的空间构型为
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该配合物的1个配体中含有σ键的数目为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族的元素,在化学上称为铁系元素,其化合物在生产生活中应用广泛。
(1)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括___________(填字母)。
(2)镍能形成多种配合物,如Ni(CO)4、[Ni(CN)4]2-、[Ni(NH3)6]2+等,下列有关说法正确的是___________(填选项字母)。
(3)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是___________ 。
(4)CoxNi(1-x)Fe2O4中Co、Ni的化合价都是+2,则Fe的化合价是___________ 。Fe3+比Fe2+更稳定的原因是___________ 。
(5)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO 、H2O,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是
、H2O,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是___________ ,其中心原子的杂化轨道类型是___________ 。
(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型,Ni(CO)4易溶于___________(填标号)。
(1)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括___________(填字母)。
| A.极性共价键 | B.离子键 | C.配位键 | D.金属键 |
| A.[Ni(NH3)6]2+中含有共价键和离子键 |
| B.CO与CN—互为等电子体,其中CO分子内σ键和π键的个数比为1:2 |
| C.NH3中N原子为sp3杂化,其空间构型为正四面体形 |
| D.Ni2+在形成配合物时其配位数只能为4,Fe在形成配合物时其配位数只能为6 |
(4)CoxNi(1-x)Fe2O4中Co、Ni的化合价都是+2,则Fe的化合价是
(5)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO
 、H2O,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是
、H2O,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型,Ni(CO)4易溶于___________(填标号)。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
您最近一年使用:0次



