目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。
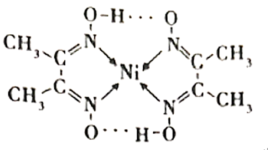
①基态Ni原子的电子排布式为___________ ,该元素在元素周期表中的位置是___________ 。
②元素C、N、O的电负性由大到小顺序为___________ 。
③二丁二酮肟合镍中存在的化学键有___________ (填标号)。
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为___________ 。
(2)工业上采用反应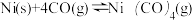 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有___________ 个δ键。
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。
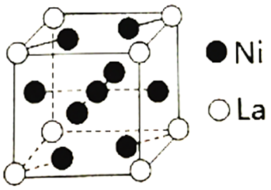
①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为___________ g·cm-3。
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为___________ 。
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。

①基态Ni原子的电子排布式为
②元素C、N、O的电负性由大到小顺序为
③二丁二酮肟合镍中存在的化学键有
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为
(2)工业上采用反应
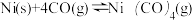 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。

①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为
更新时间:2021-07-10 19:21:24
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】青蒿素(C15H22O5)是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。

(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚(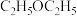 )提取,效果更好。
)提取,效果更好。
①乙醚的沸点低于乙醇,原因是___________ 。
②用乙醚提取效果更好,原因是___________ 。
(2)确定结构
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。一般来说,元素的电负性越强,其原子核附近电子云密度越大;比较青蒿素分子中C、H、O的原子核附近电子云密度大小:___________ 。
②图中晶胞的棱长分别为anm、bnm、cnm,晶体的密度为___________  。(用
。(用 表示阿伏加德罗常数;
表示阿伏加德罗常数;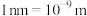 ;青蒿素的相对分子质量为282)
;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是___________ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
 (双氢青蒿素)
(双氢青蒿素)
① 的空间结构为
的空间结构为___________ 。
②双氢青蒿素分子中O-Oσ键的类型为___________ (填选项)。
A.s-p B.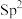 -p C.
-p C. D.
D.
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。

(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚(
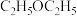 )提取,效果更好。
)提取,效果更好。①乙醚的沸点低于乙醇,原因是
②用乙醚提取效果更好,原因是
(2)确定结构
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。一般来说,元素的电负性越强,其原子核附近电子云密度越大;比较青蒿素分子中C、H、O的原子核附近电子云密度大小:
②图中晶胞的棱长分别为anm、bnm、cnm,晶体的密度为
 。(用
。(用 表示阿伏加德罗常数;
表示阿伏加德罗常数;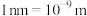 ;青蒿素的相对分子质量为282)
;青蒿素的相对分子质量为282)③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。 (双氢青蒿素)
(双氢青蒿素)①
 的空间结构为
的空间结构为②双氢青蒿素分子中O-Oσ键的类型为
A.s-p B.
 -p C.
-p C. D.
D.
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。请回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2)根据价层电子对互斥模型, 的空间构型为
的空间构型为 ___________ ,与 互为等电子体的离子、分子有
互为等电子体的离子、分子有 ___________ 、___________ (各写1个)。
(3)Sn的原子序数为50,与碳同主族,基态Sn原子的价电子排布图为___________ 。
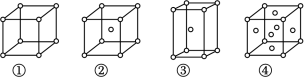
(4)金属铜在元素周期表___________ 区,采用下列 ___________ 堆积方式(填序号)。
(5)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)。H、O、N三种元素的电负性从大到小的顺序为___________ ,乙二胺分子中N原子成键时采取的杂化类型是 ___________ 。

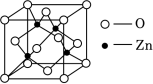
(6)锌与氧形成的ZnO晶体具有四种晶体结构,其中闪锌矿结构与金刚石相似,晶胞如图所示。该ZnO晶体熔点远远高于干冰,原因是___________ ,晶胞参数为apm,该晶体密度为 ___________ g•cm﹣3(写出表达式)。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)根据价层电子对互斥模型,
 的空间构型为
的空间构型为  互为等电子体的离子、分子有
互为等电子体的离子、分子有 (3)Sn的原子序数为50,与碳同主族,基态Sn原子的价电子排布图为
(4)金属铜在元素周期表

(5)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)。H、O、N三种元素的电负性从大到小的顺序为

(6)锌与氧形成的ZnO晶体具有四种晶体结构,其中闪锌矿结构与金刚石相似,晶胞如图所示。该ZnO晶体熔点远远高于干冰,原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________ ,烟花燃放过程中,钾元素中的电子跃迁的方式是___________ ,K、S、N、O四种元素第一电离能由大到小的顺序为___________ 。上述反应涉及的元素中电负性最大的是___________ (填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为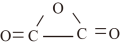 )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________ ,CO2分子的立体构型为___________ 。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________ 。
③CO分子中π键与σ键个数比为___________ 。
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为___________ ,若晶胞参数为dpm,则该超氧化物的密度为___________ g·cm-3(用含d、NA的代数式表示,设NA表示阿伏伽德罗常数的值)。
(1)氮原子的价层电子排布图为
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为
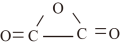 )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。①C2O3中碳原子的杂化轨道类型为
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是
③CO分子中π键与σ键个数比为
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
(4)如图所示的化合物,中心离子的配位数为_______ 。
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】石墨烯液冷散热技术系我国首创,所使用材料石墨烯是一种二维碳纳米材料。
I.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)

(1)写出构成石墨烯的碳基态原子电子排布式___________ ,图甲中,1号C与相邻C形成 键的个数为
键的个数为___________ 。
(2)图乙中,1号C的杂化方式是___________ ,若将图乙中所示的氧化石墨烯分散在 中,则氧化石墨烯中可与
中,则氧化石墨烯中可与 形成氢键的原子有
形成氢键的原子有___________ (填元素符号)。
(3)由石墨烯转化的富勒烯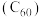 与某金属M可制备一种低温超导材料,晶胞如图丙所示。该晶胞中M原子的个数为
与某金属M可制备一种低温超导材料,晶胞如图丙所示。该晶胞中M原子的个数为___________ ,该材料中M原子和C原子的最简个数比为___________ 。
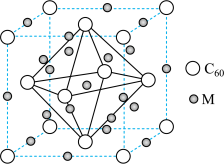
图丙
Ⅱ.
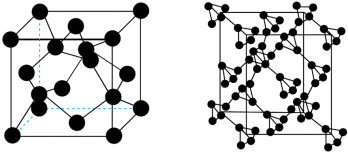
(4)T-碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,其硬度较大,原子间空隙较大,有利于做储能材料。金刚石和T-碳的晶胞如图所示。下列说法正确的是___________。
(5)晶体硅的结构跟金刚石相似, 晶体硅中所含有硅硅单键的数目是
晶体硅中所含有硅硅单键的数目是___________ ( 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
I.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)

(1)写出构成石墨烯的碳基态原子电子排布式
 键的个数为
键的个数为(2)图乙中,1号C的杂化方式是
 中,则氧化石墨烯中可与
中,则氧化石墨烯中可与 形成氢键的原子有
形成氢键的原子有(3)由石墨烯转化的富勒烯
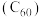 与某金属M可制备一种低温超导材料,晶胞如图丙所示。该晶胞中M原子的个数为
与某金属M可制备一种低温超导材料,晶胞如图丙所示。该晶胞中M原子的个数为
图丙
Ⅱ.
(4)T-碳的晶体结构可看作将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,其硬度较大,原子间空隙较大,有利于做储能材料。金刚石和T-碳的晶胞如图所示。下列说法正确的是___________。

| A.每个金刚石晶胞平均含有8个碳原子 | B.T-碳是一种新型的含碳化合物 |
| C.T-碳晶体属于共价晶体 | D.T-碳中键角是 |
 晶体硅中所含有硅硅单键的数目是
晶体硅中所含有硅硅单键的数目是 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、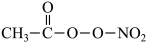 (PAN)等二次污染物。
(PAN)等二次污染物。
① 1 mol PAN中含有的σ键数目为________ 。PAN中四种元素的第一电离能由大到小的顺序为________________ 。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为________ ,中心离子的核外电子排布式为________________________ 。
③ 相同压强下,乙醇的沸点比CH3OCH3________ (填“高”或“低”),其原因是_____________ 。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及________ (填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为________ ,阴离子的中心原子轨道采用________ 杂化。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=____________ (填数字)。

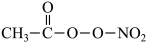 (PAN)等二次污染物。
(PAN)等二次污染物。① 1 mol PAN中含有的σ键数目为
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为
③ 相同压强下,乙醇的沸点比CH3OCH3
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号)
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为___________ ,中心原子的杂化轨道类型为___________ 。
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为___________ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为___________ ;晶胞中A原子的配位数为___________ ;列式计算晶体F的密度(g·cm-3)___________ 。

(1)四种元素中电负性最大的是
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(1)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:

①该配合物中碳原子的杂化类型有___________ 种(填数字)。
②该配合物中存在的化学键有___________ (填字母)。
a.离子键b.配位键c.金属键d.共价键e.氢键
(2)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的N原子有___________ 个;若该晶胞的密度为ρg∙cm-3,阿伏加德罗常数的值为NA,则晶胞中Ti原子与Ti原子的最近距离为___________ pm。(用含ρ、NA的代数式表示)

(3)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为___________ 。

(4)烧结高密度氮化硼时,添加一定量的硼钛二元化合物可得到立方氮化硼,其晶体结构如图2,图中X点的原子坐标为___________ 。

(1)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:

①该配合物中碳原子的杂化类型有
②该配合物中存在的化学键有
a.离子键b.配位键c.金属键d.共价键e.氢键
(2)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的N原子有

(3)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为

(4)烧结高密度氮化硼时,添加一定量的硼钛二元化合物可得到立方氮化硼,其晶体结构如图2,图中X点的原子坐标为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界。
(1)W原子价电子的轨道表达式为_____________ 。
(2)WX的等电子体有N2、_______ 等。WN-与WX均为配合物中常见的配体,WN-作配体时,提供孤电子对的通常是W原子而不是氮原子,其原因是_________ 。
(3)ZX2的空间构型是______________ 。
(4)YF4遇水易发生水解,水解后产生的HF与部分YF4生成配离子YF62-,其反应的化学方程式为:3YF4+4H2O=H4YO4+2H2YF6。该反应混合物中,中心原子杂化方式相同的分子是_________ 。
(5)一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到。其中硅原子的配位数为_______ ;已知该晶体的密度为ag/cm3,则该晶胞的棱长为______ pm(用含a 、NA的代数式表示)。
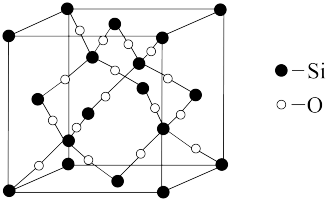
(1)W原子价电子的轨道表达式为
(2)WX的等电子体有N2、
(3)ZX2的空间构型是
(4)YF4遇水易发生水解,水解后产生的HF与部分YF4生成配离子YF62-,其反应的化学方程式为:3YF4+4H2O=H4YO4+2H2YF6。该反应混合物中,中心原子杂化方式相同的分子是
(5)一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到。其中硅原子的配位数为

您最近一年使用:0次



