某校化学兴趣小组为探究浓、稀硝酸与金属铝反应的异同,实验装置如下图,请回答下列问题:

(1)实验开始前先将A、B、C、D连接在一起,打开弹簧夹,通一段时间的氮气,其目的为_______ 。然后再关闭弹簧夹,连接E、F装置。
(2)甲同学先向A中滴加20mL稀硝酸,观察到C中气体为无色,D中导气管口有气泡冒出。试写出此时A中反应的离子方程式_______ 。接下来他把稀硝酸换成浓硝酸,重复上述操作,观察到C中气体仍然为无色,D中导气管口也有气泡冒出。于是得出结论:无论浓硝酸还是稀硝酸,与金属铝反应生成的气体产物相同。你认为甲同学的结论是否正确?_______ (填“是”或“否”)。加浓硝酸时“D中导气管口也有气泡冒出”是因为_______ 。
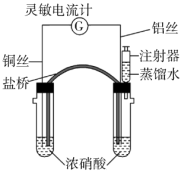
(3)乙同学用电化学方法来测定使铝钝化时硝酸的最低浓度,装置如下图。向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g·mL-1),将金属丝插入溶液中,开始实验时,观察到灵敏电流计指针指向正极_______ (填“铜”或“铝”),此时电池的正极反应式为_______ ,但指针又迅速反转。用盛蒸馏水的注射器缓慢向右边具支试管内加水并振荡,当出现_______ 的现象时,抽出金属丝停止实验。重复三次实验得平均加水量为2.5mL据此计算,使铝钝化的硝酸溶液的最低溶质质量分数为_______ (结果保留3位有效数字)。

(1)实验开始前先将A、B、C、D连接在一起,打开弹簧夹,通一段时间的氮气,其目的为
(2)甲同学先向A中滴加20mL稀硝酸,观察到C中气体为无色,D中导气管口有气泡冒出。试写出此时A中反应的离子方程式
(3)乙同学用电化学方法来测定使铝钝化时硝酸的最低浓度,装置如下图。向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g·mL-1),将金属丝插入溶液中,开始实验时,观察到灵敏电流计指针指向正极

20-21高一下·湖北·阶段练习 查看更多[2]
更新时间:2021-07-16 13:10:48
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氮及其化合物是重要的化工原料。回答下列问题:
(1)利用如图所示装置及药品制取氨气。
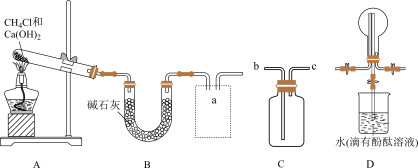
①写出A中制取氨气的化学方程式;___________ 。
②C为方框内氨气的收集装置,则a应与___________ (填“b”或“c”)相连。
③证明氨气已集满的操作和现象是___________ 。
(2)若观察到装置D中的烧瓶内产生了红色喷泉。则说明氨气具有的性质是___________ 。
(3)氨经催化氧化可制备硝酸,写出氨催化氧化的化学方程式:___________ 。
(4) 可用碱液吸收:
可用碱液吸收: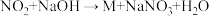 (未配平),已知M是一种盐,且在生成物中M与
(未配平),已知M是一种盐,且在生成物中M与 的物质的量比为
的物质的量比为 。则M的化学名称为
。则M的化学名称为___________ 。
(5)将mgCu与足量的稀硝酸混合,充分反应后,收集到2.24L(标准状况)气体,则
___________ 。
(1)利用如图所示装置及药品制取氨气。

①写出A中制取氨气的化学方程式;
②C为方框内氨气的收集装置,则a应与
③证明氨气已集满的操作和现象是
(2)若观察到装置D中的烧瓶内产生了红色喷泉。则说明氨气具有的性质是
(3)氨经催化氧化可制备硝酸,写出氨催化氧化的化学方程式:
(4)
 可用碱液吸收:
可用碱液吸收: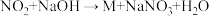 (未配平),已知M是一种盐,且在生成物中M与
(未配平),已知M是一种盐,且在生成物中M与 的物质的量比为
的物质的量比为 。则M的化学名称为
。则M的化学名称为(5)将mgCu与足量的稀硝酸混合,充分反应后,收集到2.24L(标准状况)气体,则

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。

实验操作及现象:
试回答下列问题:
(1)操作I中产生气体的化学式为___ 。操作I的目的是___ 。D装置的作用是__ 。
(2)操作II中当C装置中产生白色沉淀时立刻将B装置上提的原因是__ 。
(3)操作III中A装置中产生无色气体的化学方程式是__ 。
(4)E装置内气体颜色逐渐加深的原因是__ 。
(5)操作V现象产生的原因是(用两个化学方程式说明)___ ,__ 。

实验操作及现象:
| 实验操作 | 现象 |
| I.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| II.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| III.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体,E装置中开始时出现浅红棕色气体 |
| IV.用F装置向E装置中鼓入空气 | E装置中气体颜色逐渐加深 |
| V.一段时间后 | C装置中白色沉淀溶解 |
(1)操作I中产生气体的化学式为
(2)操作II中当C装置中产生白色沉淀时立刻将B装置上提的原因是
(3)操作III中A装置中产生无色气体的化学方程式是
(4)E装置内气体颜色逐渐加深的原因是
(5)操作V现象产生的原因是(用两个化学方程式说明)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N-N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为_______ ;
结论:N2分子中“σ”和“π”键的稳定性_______ 。
(2)氮的氧化物是大气污染物之一、为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:

其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
I.①和②分别为(写化学式)_______ 、_______ ;
Ⅱ.氧化室发生的反应是_______ ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3-形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是_______ ,与同一个N3-相连的M+有_______ 个。

(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:

其中反应②为:4NO+3O2+2H2O=4HNO3原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
I.写出反应①的化学方程式_______ 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为_______ 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为________ (写出计算过程)
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N-N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为
结论:N2分子中“σ”和“π”键的稳定性
(2)氮的氧化物是大气污染物之一、为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:

其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
I.①和②分别为(写化学式)
Ⅱ.氧化室发生的反应是
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3-形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是

(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:

其中反应②为:4NO+3O2+2H2O=4HNO3原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
I.写出反应①的化学方程式
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】已知木炭还原氧化铜实验中发生的主要反应:C+2CuO 2Cu+CO2↑。
2Cu+CO2↑。
某化学实验小组对该实验产物(假设已完全反应)进行了下探究:
探究一:检验产物的成分
[提出问题]实验产物是暗红色固体,很难观察到紫红色固体。而该暗红色固体是什么?
[查阅资料]氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
[猜想假设]暗红色固体除铜外还可能含有Cu2O。
[设计实验]
(1)取少量暗红色固体,加入稀硫酸,如果观察到___________ ,说明猜想正确。
探究二:测定产物中Cu2O的含量。
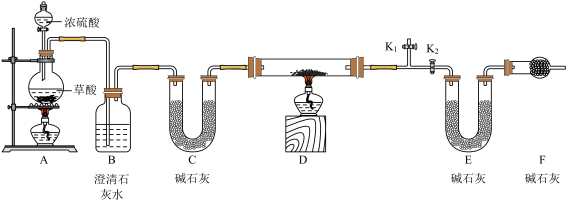
[查阅资料]草酸在浓硫酸的作用下会分解为CO和CO2。
[设计实验]称取固体样品6.0g,置于上图装置D中进行实验(固定装置已略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(2)证明草酸的分解产物中有CO2存在的是___________ 。
(3)装置C的作用是___________ 。
(4)写出装置D中反应的化学方程式___________ 。
(5)下列为加热装置前所涉及的部分操作,正确的顺序是___________ (填序号)。
①检查装置的气密性
②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器
④关闭K1,打开K2
(6)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为___________ 。
 2Cu+CO2↑。
2Cu+CO2↑。某化学实验小组对该实验产物(假设已完全反应)进行了下探究:
探究一:检验产物的成分
[提出问题]实验产物是暗红色固体,很难观察到紫红色固体。而该暗红色固体是什么?
[查阅资料]氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
[猜想假设]暗红色固体除铜外还可能含有Cu2O。
[设计实验]
(1)取少量暗红色固体,加入稀硫酸,如果观察到
探究二:测定产物中Cu2O的含量。

[查阅资料]草酸在浓硫酸的作用下会分解为CO和CO2。
[设计实验]称取固体样品6.0g,置于上图装置D中进行实验(固定装置已略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(2)证明草酸的分解产物中有CO2存在的是
(3)装置C的作用是
(4)写出装置D中反应的化学方程式
(5)下列为加热装置前所涉及的部分操作,正确的顺序是
①检查装置的气密性
②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器
④关闭K1,打开K2
(6)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验题:
Ⅰ.某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时是否需要与水接触。
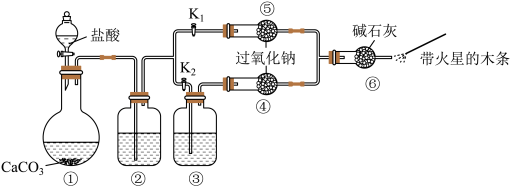
【装置分析】
(1)已知盐酸具有挥发性。装置②中的试剂是饱和 溶液,装置②的作用是
溶液,装置②的作用是_______ 。
(2)装置③中的试剂是浓硫酸,作用是_______ 。
【进行实验】
步骤1:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。
步骤2:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。
(3)步骤1和步骤2中,带火星的木条产生的实验现象分别是无明显现象、带火星木条复燃。这说明_______
(4)请写出过氧化钠跟二氧化碳反应的化学方程式并用双线桥标出电子转移:_______ 。
Ⅰ.某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时是否需要与水接触。

【装置分析】
(1)已知盐酸具有挥发性。装置②中的试剂是饱和
 溶液,装置②的作用是
溶液,装置②的作用是(2)装置③中的试剂是浓硫酸,作用是
【进行实验】
步骤1:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。步骤2:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在如图所示处。(3)步骤1和步骤2中,带火星的木条产生的实验现象分别是无明显现象、带火星木条复燃。这说明
(4)请写出过氧化钠跟二氧化碳反应的化学方程式并用双线桥标出电子转移:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某校化学兴趣小组为研究 的性质,设计如图所示装置进行实验。装置Ⅲ中
的性质,设计如图所示装置进行实验。装置Ⅲ中 为干燥的红色纸,b为湿润的红色纸。
为干燥的红色纸,b为湿润的红色纸。

(1)实验室用二氧化锰和浓盐酸制备氯气的化学方程式为___________ 。理论上有 的
的 被氧化时,可产生标准状况下的气体体积为
被氧化时,可产生标准状况下的气体体积为___________ L。
(2)装置Ⅱ的作用是___________ 。
(3)实验过程中装置Ⅳ中的实验现象为___________ 。
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了观察到这一预期现象,你认为还需在装置Ⅱ与Ⅲ之间添加下列___________ (填标号)装置。

(5) 为国际公认高效安全灭菌消毒剂之一、用潮湿的
为国际公认高效安全灭菌消毒剂之一、用潮湿的 与
与 以等物质的量反应,生成
以等物质的量反应,生成 、气体
、气体 和另一种盐
和另一种盐 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:___________ 。
(6)电解饱和食盐水,负极生成的是氢气和氢氧化钠。某实验小组在实验室通过图1装置制备氯气,理论上气球 和气球
和气球 的体积相等,实验中发现气球
的体积相等,实验中发现气球 的体积小于气球
的体积小于气球 ,其可能的原因是
,其可能的原因是___________ 。某同学研究发现,经过改装后的实验装置(如图2)可制备消毒液,则由此判断电源的 极为
极为___________ (填“正”或“负”)极。

 的性质,设计如图所示装置进行实验。装置Ⅲ中
的性质,设计如图所示装置进行实验。装置Ⅲ中 为干燥的红色纸,b为湿润的红色纸。
为干燥的红色纸,b为湿润的红色纸。
(1)实验室用二氧化锰和浓盐酸制备氯气的化学方程式为
 的
的 被氧化时,可产生标准状况下的气体体积为
被氧化时,可产生标准状况下的气体体积为(2)装置Ⅱ的作用是
(3)实验过程中装置Ⅳ中的实验现象为
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了观察到这一预期现象,你认为还需在装置Ⅱ与Ⅲ之间添加下列

(5)
 为国际公认高效安全灭菌消毒剂之一、用潮湿的
为国际公认高效安全灭菌消毒剂之一、用潮湿的 与
与 以等物质的量反应,生成
以等物质的量反应,生成 、气体
、气体 和另一种盐
和另一种盐 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:(6)电解饱和食盐水,负极生成的是氢气和氢氧化钠。某实验小组在实验室通过图1装置制备氯气,理论上气球
 和气球
和气球 的体积相等,实验中发现气球
的体积相等,实验中发现气球 的体积小于气球
的体积小于气球 ,其可能的原因是
,其可能的原因是 极为
极为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某研究性学习小组的同学为了制取NO并探究其性质,进行了如下实验。
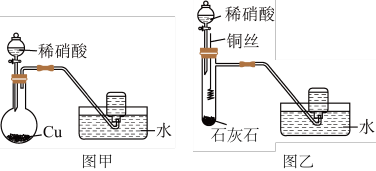
试回答下列问题:
(1)某同学用图甲装置进行实验,收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。该同学的推断不合理的理由是__________ (用化学方程式表示)。
(2)另一名同学设计了图乙装置进行实验,步骤如下:①在大试管中放入适量石灰石,加入过量稀硝酸;②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体。其中步骤①的作用是___________ 。
(3)当过量的铜与稀硝酸完全反应后,再加20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是___ (填选项编号),反应的离子方程式为__________ 。
a.还原剂 b.氧化剂 c.提供氢离子 d.提供热能
(4)某些资料认为NO不能与Na2O2反应。有同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。
查阅资料:a.2NO+Na2O2=2NaNO2
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O
c.酸性条件下,NO能被MnO 氧化成NO
氧化成NO
该同学利用图中装置来探究NO与Na2O2的反应(装置可重复使用)。
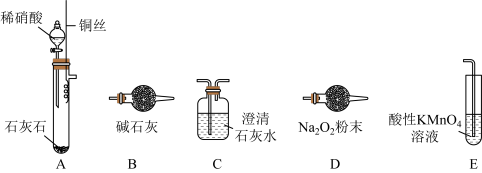
①装置的连接顺序为A→_________ ,装置E的作用是 __________ 。
②充分反应后,欲检验装置D中是否生成了NaNO2,请简述实验方案_________________ 。

试回答下列问题:
(1)某同学用图甲装置进行实验,收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。该同学的推断不合理的理由是
(2)另一名同学设计了图乙装置进行实验,步骤如下:①在大试管中放入适量石灰石,加入过量稀硝酸;②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体。其中步骤①的作用是
(3)当过量的铜与稀硝酸完全反应后,再加20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是
a.还原剂 b.氧化剂 c.提供氢离子 d.提供热能
(4)某些资料认为NO不能与Na2O2反应。有同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。
查阅资料:a.2NO+Na2O2=2NaNO2
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O
c.酸性条件下,NO能被MnO
 氧化成NO
氧化成NO
该同学利用图中装置来探究NO与Na2O2的反应(装置可重复使用)。
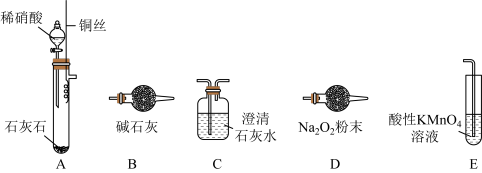
①装置的连接顺序为A→
②充分反应后,欲检验装置D中是否生成了NaNO2,请简述实验方案
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成NO和NO2的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。

请回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择___________ (填装置序号)。
(2)实验中气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出______ 。

(3)连接好装置,检查气密性后,应进行的操作:
第一:打开b,向C装置的乙管中加适量水;
第二:_________________________________________________________________________ ;
第三:将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面的活塞拧开,向烧瓶中加入浓硝酸,与铜反应。
(4)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应将乙管_______ (填“向上”或“向下”)移动,使________________________ 。
(5)实验后若量气管中气体的体积(已换算成标准状况)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m=____________________________ (结果可不必化简)。

请回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择
(2)实验中气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出

(3)连接好装置,检查气密性后,应进行的操作:
第一:打开b,向C装置的乙管中加适量水;
第二:
第三:将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面的活塞拧开,向烧瓶中加入浓硝酸,与铜反应。
(4)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应将乙管
(5)实验后若量气管中气体的体积(已换算成标准状况)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m=
您最近一年使用:0次



