化合物 A 由三种短周期元素组成,某兴趣小组进行了如下实验:
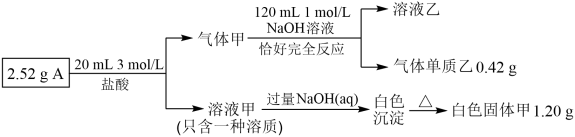
已知:气体甲为纯净物且只含两种元素,在标况下体积为 672 mL;固体甲为常用的耐火材料,溶液乙为建筑行业中常用的粘合剂。请回答下列问题:
(1)A 的组成元素为___________ (用元素符号表示),A 的化学式为___________ ;
(2)写出A溶于盐酸的化学方程式___________ 。
(3)写出气体甲与 NaOH(aq)反应的离子方程式___________ 。
(4)往溶液乙中通入少量 CO2气体发生的化学方程式___________ 。
(5)高温下A 与足量氯气能发生剧烈爆炸,生成三种常见化合物,试写出相应的化学方程式___________ 。

已知:气体甲为纯净物且只含两种元素,在标况下体积为 672 mL;固体甲为常用的耐火材料,溶液乙为建筑行业中常用的粘合剂。请回答下列问题:
(1)A 的组成元素为
(2)写出A溶于盐酸的化学方程式
(3)写出气体甲与 NaOH(aq)反应的离子方程式
(4)往溶液乙中通入少量 CO2气体发生的化学方程式
(5)高温下A 与足量氯气能发生剧烈爆炸,生成三种常见化合物,试写出相应的化学方程式
2021高三·全国·专题练习 查看更多[3]
(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)单科化学-2021年秋季高三开学摸底考试卷02(课标全国专用)(已下线)第11讲 碳、硅及无机非金属材料(精练)-2022年高考化学一轮复习讲练测
更新时间:2021-07-25 08:01:44
|
相似题推荐
【推荐1】燃煤烟气中SO2和NOx是大气污染物的主要来源,脱硫脱硝技术是烟气治理技术的研究热点。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原制,具有弱碱性。60°C时在一定浓度的尿素/ H2O溶液中通入含有SO2和NO的烟气。烟气中有毒气体被一定程度吸收。
①尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为_________________________________________ 。
②尿素/H2O2溶液对NO的吸收去除效果不如SO2吸收去除效果,原因是____________________________ 。
③脱硝时H2O2能将NO氧化为NO2及HNO3等,促进2HNO3+CO(NH2)2=2N2↑+CO2↑+ 3H2O等氧化还原反应的发生。尿素/H2O2溶液脱硫脱硝一般控制温度为50°C~ 70°C,过高的温度会导致NO去除率降低的原因是______________________________________________________________ 。
(2)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。单一炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2被炭表面的含氧官能团催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为_____________________________________________ 。
②V2O5/炭基材料脱硫脱硝时,控制一定气体流量和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示:
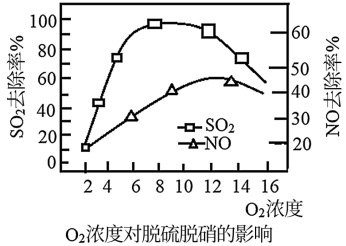
当氧气浓度过高时,去除效率下降,其可能原因是___________________ 。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原制,具有弱碱性。60°C时在一定浓度的尿素/ H2O溶液中通入含有SO2和NO的烟气。烟气中有毒气体被一定程度吸收。
①尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为
②尿素/H2O2溶液对NO的吸收去除效果不如SO2吸收去除效果,原因是
③脱硝时H2O2能将NO氧化为NO2及HNO3等,促进2HNO3+CO(NH2)2=2N2↑+CO2↑+ 3H2O等氧化还原反应的发生。尿素/H2O2溶液脱硫脱硝一般控制温度为50°C~ 70°C,过高的温度会导致NO去除率降低的原因是
(2)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。单一炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2被炭表面的含氧官能团催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为
②V2O5/炭基材料脱硫脱硝时,控制一定气体流量和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示:

当氧气浓度过高时,去除效率下降,其可能原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】查阅文献知,3(NH4)2SO4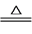 4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
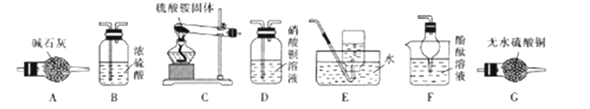
回答下列问题:
(1)A装置盛装碱石灰的仪器是_________ 。C装置中大试管向下倾斜的原因是__________________ 。
(2)甲组同学设计方案:C→G→B→D→E。
①能证明有水生成的实验现象是_______________ ;B装置的作用是______________ 。
②实验中,观察到D装置中产生白色沉淀。实验完毕后,过滤D装置中混合物得白色沉淀。为了检验白色沉淀是BaSO4还是BaSO3,设计简单实验方案:________________ 。
③D装置中发生反应与硝酸钡的量有关,若硝酸钡足量,则D中反应的离子方程式为_______________ 。
④该实验方案能证明硫酸铵的分解产物是______________ (填化学式)。
(3)乙组同学选择上述装置证明产物是否有NH3。
①气体从左至右,装置连接顺序为C、__________ 。
②能证明有氨气生成的实验现象是________________ 。
(4)丙组同学设计实验测定硫酸铵样品的纯度(杂质不参加反应):取15.0g样品溶于蒸馏水,加入足量氯化钡溶液和稀盐酸,过滤、洗涤、干燥、称重,BaSO4质量为23.3g,该样品中硫酸铵的质量分数为________ (结果保留两位小数)。
 4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
回答下列问题:
(1)A装置盛装碱石灰的仪器是
(2)甲组同学设计方案:C→G→B→D→E。
①能证明有水生成的实验现象是
②实验中,观察到D装置中产生白色沉淀。实验完毕后,过滤D装置中混合物得白色沉淀。为了检验白色沉淀是BaSO4还是BaSO3,设计简单实验方案:
③D装置中发生反应与硝酸钡的量有关,若硝酸钡足量,则D中反应的离子方程式为
④该实验方案能证明硫酸铵的分解产物是
(3)乙组同学选择上述装置证明产物是否有NH3。
①气体从左至右,装置连接顺序为C、
②能证明有氨气生成的实验现象是
(4)丙组同学设计实验测定硫酸铵样品的纯度(杂质不参加反应):取15.0g样品溶于蒸馏水,加入足量氯化钡溶液和稀盐酸,过滤、洗涤、干燥、称重,BaSO4质量为23.3g,该样品中硫酸铵的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】工业污酸因酸性强,且含有大量As(Ⅲ)等毒性物质不可直接排放,用锌冶炼的窑渣处理含砷废酸可实现砷、酸的高效脱除,同时获得有价金属铜、铁。工艺流程如下:
②氧化浸出后清液主要成分(g·L-1):
③As(Ⅴ)毒性较As(Ⅲ)弱。
请回答下列问题:
(1)污酸预处理工艺中加入H2O2的作用是_______ 。_______ ,若该步骤不通入氧气,将影响锌窑渣中_______ (填化学式)成分的溶浸。
(3)沉砷时反应的化学方程式为_______ 。
(4)加入铁粉的主要目的是沉铜,写出该过程可能发生的离子方程式:______________ 。
(5)滤渣2的主要成分为_______ (填化学式)。
(6)取1.00mL水解前样品放入锥形瓶,再加入10mL蒸馏水,滴入指示剂,用0.01mol·L-1酸性K2Cr2O7溶液滴定至终点。重复实验三次,消耗标准液的体积分别为5.98mL、6.02mL、6.30mL,则样品中Fe2+的浓度为_______ (写出计算过程)。

②氧化浸出后清液主要成分(g·L-1):
| H2SO4 | Fe2+ | Fe3+ | Cu2+ | As(主要以H3AsO4形式存在) |
| 18.9 | 17.8 | 6.6 | 1.65 | 8.85 |
请回答下列问题:
(1)污酸预处理工艺中加入H2O2的作用是

(3)沉砷时反应的化学方程式为
(4)加入铁粉的主要目的是沉铜,写出该过程可能发生的离子方程式:
(5)滤渣2的主要成分为
(6)取1.00mL水解前样品放入锥形瓶,再加入10mL蒸馏水,滴入指示剂,用0.01mol·L-1酸性K2Cr2O7溶液滴定至终点。重复实验三次,消耗标准液的体积分别为5.98mL、6.02mL、6.30mL,则样品中Fe2+的浓度为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐1】通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力。请按要求回答下列问题:
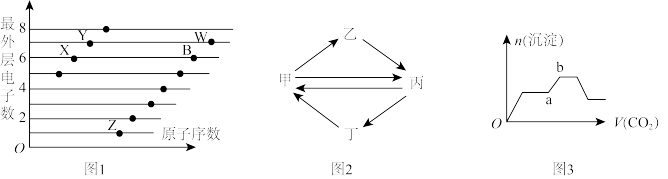
(1)图1是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
①Y元素在元素周期表中的位置为_______________ 。
②气态氢化物的稳定性:X_____ (填“>”“<”)Y。
③这五种元素形成的简单离子中,离子半径最大的是_______ (填离子符号)。
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为_________________ 。
(2)图2是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是__________
(3)图3表示将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系,则ab段发生反应的离子方程式为_______________________________

(1)图1是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
①Y元素在元素周期表中的位置为
②气态氢化物的稳定性:X
③这五种元素形成的简单离子中,离子半径最大的是
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为
(2)图2是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是
| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | NO | HNO3 | NO2 | NH3 |
| D | Si | Na2SiO3 | SiO2 | SiF4 |
您最近一年使用:0次
【推荐1】氟化镁有诸多优良性质,在光学、冶金、国防、医疗等领域有着广泛的应用,如图给出了镁碳化法制备高纯氟化镁的一般流程。
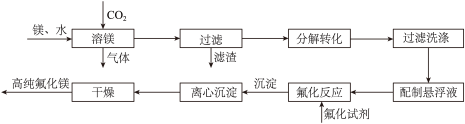
已知:碳酸氢镁受热易分解为MgCO3•nH2O。
(1)原料镁中含有铁元素,铁原子的价电子排布式为______ ,镁原子的第三电离能陡增的原因是______ 。
(2)“溶镁”的主要目的是得到碳酸氢镁,写出发生的离子方程式______ 。
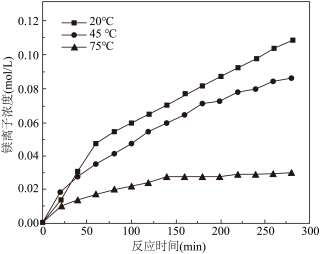
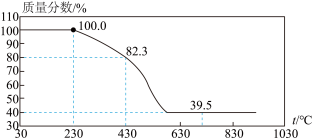
(3)“溶镁”过程中,在搅拌条件下持续通入30mL/min高纯二氧化碳气体,其他条件相同,研究不同温度下反应体系中镁离子浓度和反应时间的关系,实验结果如图所示。由图可以看出,反应温度越高,相同时间内生成的碳酸氢镁浓度______ (填“越低”或“越高”),可能的原因有______ 。
(4)碳酸氢镁热分解转化的单一固体产物可能含有一定的结晶水,用热重分析法可测定结晶水含量。称取100g上述分解转化产物进行热重分析,热重曲线如图所示,产物化学式为______ 。
(5)氟化反应以氢氟酸为氟化试剂,写出其离子方程式______ ,整个流程中可以循环利用的物质为_______ 。
(6)氟化镁的晶胞结构为四方晶胞,若晶胞边长a=b=0.46nm,c=0.30nm,则氟化镁密度ρ=______ g•cm-3(列出计算式即可)。


已知:碳酸氢镁受热易分解为MgCO3•nH2O。
(1)原料镁中含有铁元素,铁原子的价电子排布式为
(2)“溶镁”的主要目的是得到碳酸氢镁,写出发生的离子方程式
(3)“溶镁”过程中,在搅拌条件下持续通入30mL/min高纯二氧化碳气体,其他条件相同,研究不同温度下反应体系中镁离子浓度和反应时间的关系,实验结果如图所示。由图可以看出,反应温度越高,相同时间内生成的碳酸氢镁浓度

(4)碳酸氢镁热分解转化的单一固体产物可能含有一定的结晶水,用热重分析法可测定结晶水含量。称取100g上述分解转化产物进行热重分析,热重曲线如图所示,产物化学式为

(5)氟化反应以氢氟酸为氟化试剂,写出其离子方程式
(6)氟化镁的晶胞结构为四方晶胞,若晶胞边长a=b=0.46nm,c=0.30nm,则氟化镁密度ρ=

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
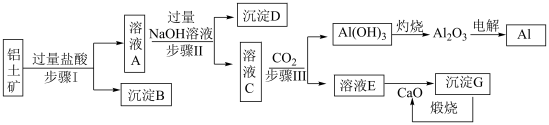
【推荐2】铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图:_______ 。
(2)写出步骤Ⅲ通入过量的CO2时发生的离子方程式_______ ,步骤I、Ⅱ、Ⅲ都要用到的分离方法是_______ 。
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有_______ (填化学式)。
(4)设计检验滤液A中是否含Fe3+的操作为_______ ;
(5)现有102t含氧化铝50%的铝土矿,经上述流程最终得金属铝20t,则产率为_______ 。
(2)写出步骤Ⅲ通入过量的CO2时发生的离子方程式
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有
(4)设计检验滤液A中是否含Fe3+的操作为
(5)现有102t含氧化铝50%的铝土矿,经上述流程最终得金属铝20t,则产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】联苄(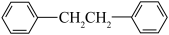 )是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度
)是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度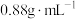 )和1,2-二氯乙烷(
)和1,2-二氯乙烷(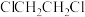 ,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
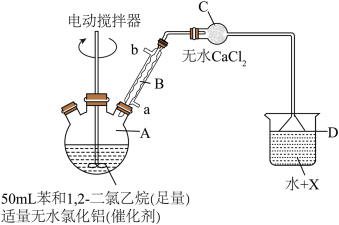
实验过程:将无水氯化铝、苯、1,2-二氯乙烷依次加入仪器A中,开动电动搅拌器将试剂混合,水浴加热(60~65℃)装置A约1h,将装置A中液态混合物,通过“一系列”操作后得到44g联苄。
回答下列问题:
(1)仪器B的名称是_______ ,若蒸馏水从b口进入,则从原料利用角度分析,导致的结果是_______ 。
(2)仪器C的作用是_______ ,若实验结束时烧杯中的液体变红,则试剂X可能是_______ 。
(3)“一系列”操作包括用稀盐酸洗涤→…→用无水硫酸镁处理→蒸馏。用稀盐酸洗涤的具体操作为_______ ,用硫酸镁处理后的操作是_______ ,蒸馏的目的是_______ 。
(4)该实验中联苯的产率为_______ (保留三位有效数字)。
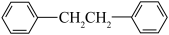 )是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度
)是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度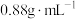 )和1,2-二氯乙烷(
)和1,2-二氯乙烷(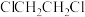 ,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
实验过程:将无水氯化铝、苯、1,2-二氯乙烷依次加入仪器A中,开动电动搅拌器将试剂混合,水浴加热(60~65℃)装置A约1h,将装置A中液态混合物,通过“一系列”操作后得到44g联苄。
回答下列问题:
(1)仪器B的名称是
(2)仪器C的作用是
(3)“一系列”操作包括用稀盐酸洗涤→…→用无水硫酸镁处理→蒸馏。用稀盐酸洗涤的具体操作为
(4)该实验中联苯的产率为
您最近一年使用:0次




