(1)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
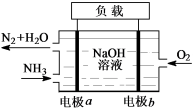
①电极a名称是___________ 。
②电解质溶液中OH-离子向___________ 移动(填“电极a”或 “电极b”)。
③电极b的电极反应式为___________ 。
④可以通过NH3跟NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学方程式为___________ 。
(2)利用甲烷催化还原氮氧化物,可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
③H2O(l)=H2O(g) △H = +44 kJ/mol
写出CH4将NO2还原为N2并生成液态水时的热化学方程式___________ 。
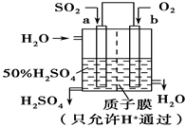
(3)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为___________ 。为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为___________ 。

①电极a名称是
②电解质溶液中OH-离子向
③电极b的电极反应式为
④可以通过NH3跟NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学方程式为
(2)利用甲烷催化还原氮氧化物,可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
③H2O(l)=H2O(g) △H = +44 kJ/mol
写出CH4将NO2还原为N2并生成液态水时的热化学方程式
(3)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为

更新时间:2021-07-28 12:38:50
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:

反应Ⅱ:

下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
(1)比较这两种合成甲醇的方法,原子利用率较高的是______ (填“I”或“Ⅱ”)。
(2)在一定条件下将2molCO和6molH2充入2L的密闭容器中发生反应Ⅰ,10min后测得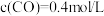 ,计算可得此段时间的反应速率(用H2表示)为
,计算可得此段时间的反应速率(用H2表示)为 ______ mol/(L·min)。
(3)由表中数据判断∆H1______ 0(填“>”、“<”或“=”);反应CO2(g)+H2(g) CO(g) + H2O(g) ∆H3, ∆H3=
CO(g) + H2O(g) ∆H3, ∆H3= ______ (用∆H1和∆H2表示)。
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=______ ;保持恒温恒容将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡______ (填“正向”、“逆向”或“不”)移动,平衡常数KⅡ______ (填“变大”、“变小”或“不变”)。
反应Ⅰ:


反应Ⅱ:


下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
(2)在一定条件下将2molCO和6molH2充入2L的密闭容器中发生反应Ⅰ,10min后测得
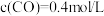 ,计算可得此段时间的反应速率(用H2表示)为
,计算可得此段时间的反应速率(用H2表示)为 (3)由表中数据判断∆H1
 CO(g) + H2O(g) ∆H3, ∆H3=
CO(g) + H2O(g) ∆H3, ∆H3= (4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)SO2的排放主要来自煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ∆H1=akJ·mol-1
②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ∆H2=bkJ·mol-1
③2(NH)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ∆H3=ckJ·mol-1
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的∆H=_____ kJ·mol-1。
(2)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g),反应方程式为2NO(g)+2CO(g) N2(g)+2CO2(g) ∆H<0。
N2(g)+2CO2(g) ∆H<0。
在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图1所示。平衡时NO的转化率为_________ ;0~15min内,v(NO)=_________ 。

(3)NOx的排放主要来自汽车尾气,有人根据反应C(s)+2NO(g) N2(g)+CO2(g) ∆H=-34.0kJ·mol-1,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,分别在催化剂M、N的作用下发生上述反应,测得NO的转化率随时间的变化关系如图2所示:
N2(g)+CO2(g) ∆H=-34.0kJ·mol-1,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,分别在催化剂M、N的作用下发生上述反应,测得NO的转化率随时间的变化关系如图2所示:

①判断T1____ T2(填“>”“<”或“=”,下同),催化效果M___ N,理由是___ 。
②在T1、1.1×106Pa时,该反应的化学平衡常数K=_______ 。
(4)以连二硫酸盐(S2O )为媒介,使用间接电化学法可处理NO,装置如图3所示。
)为媒介,使用间接电化学法可处理NO,装置如图3所示。
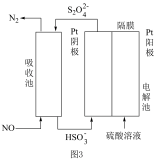
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:__________ 。
用离子方程式表示吸收池中除去NO的原理:____________ 。
(1)SO2的排放主要来自煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ∆H1=akJ·mol-1
②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ∆H2=bkJ·mol-1
③2(NH)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ∆H3=ckJ·mol-1
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的∆H=
(2)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g),反应方程式为2NO(g)+2CO(g)
 N2(g)+2CO2(g) ∆H<0。
N2(g)+2CO2(g) ∆H<0。在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图1所示。平衡时NO的转化率为

(3)NOx的排放主要来自汽车尾气,有人根据反应C(s)+2NO(g)
 N2(g)+CO2(g) ∆H=-34.0kJ·mol-1,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,分别在催化剂M、N的作用下发生上述反应,测得NO的转化率随时间的变化关系如图2所示:
N2(g)+CO2(g) ∆H=-34.0kJ·mol-1,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,分别在催化剂M、N的作用下发生上述反应,测得NO的转化率随时间的变化关系如图2所示:
①判断T1
②在T1、1.1×106Pa时,该反应的化学平衡常数K=
(4)以连二硫酸盐(S2O
 )为媒介,使用间接电化学法可处理NO,装置如图3所示。
)为媒介,使用间接电化学法可处理NO,装置如图3所示。
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:
用离子方程式表示吸收池中除去NO的原理:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】当前,全球资源紧张、气候变暖已对人类的生存和发展形成了严峻的挑战。发展低碳经济、倡导低碳生活是形势所迫,更是大势所趋。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上将CO2与焦炭作用生成CO,CO可用于炼铁,其反应原理为:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1
②C(s)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________ 。
(2)适当条件下将CO2和H2以1:3的体积比混合合成甲醇和水:CO2(g)+3H2(g)⇌CH3OH(g) +H2O(g) ΔH =-49.0 kJ·mol-1。在体积为2 L的密闭容器中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
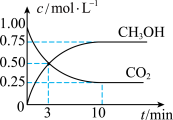
①该反应的平衡常数表达式为________ 。
②从反应开始到平衡, (H2)=
(H2)=______ ;氢气的转化率=______ ;能使平衡体系中n(CH3OH)增大的措施是___________ 。
(3)CO还可以用作燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,其负极反应式为:2CO-4e-+2 =4CO2,则正极反应式为
=4CO2,则正极反应式为__________ 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp =3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合(忽略混合后溶液体积的变化),若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为___________ 。
(1)工业上将CO2与焦炭作用生成CO,CO可用于炼铁,其反应原理为:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1
②C(s)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为
(2)适当条件下将CO2和H2以1:3的体积比混合合成甲醇和水:CO2(g)+3H2(g)⇌CH3OH(g) +H2O(g) ΔH =-49.0 kJ·mol-1。在体积为2 L的密闭容器中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①该反应的平衡常数表达式为
②从反应开始到平衡,
 (H2)=
(H2)=(3)CO还可以用作燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,其负极反应式为:2CO-4e-+2
 =4CO2,则正极反应式为
=4CO2,则正极反应式为(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp =3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合(忽略混合后溶液体积的变化),若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是___________ 。
②电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
④补充实验证实了③中的分析。
a是___________ ,b是___________ 。
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ 。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(4)总结:物质氧化性和还原性变化的一般规律是___________ 。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是
②电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
④补充实验证实了③中的分析。
| 实验操作 | 试剂 | 产物 | |
| I |  | 较浓H2SO4 | 有氯气 |
| II | a | 有氯气 | |
| III | a+b | 无氯气 |
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(4)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组同学为探究 和
和 反应的程度,进行以下实验。已知:相关物质的
反应的程度,进行以下实验。已知:相关物质的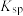 (25℃) AgCl:
(25℃) AgCl:
 :
:
(1)甲同学的实验如下:
注:经检验黑色固体为Ag。
①白色沉淀的化学式是___________ 。
②甲同学得出 氧化了
氧化了 的依据是
的依据是___________ 。
(2)乙同学为探究 和
和 反应的程度,进行实验Ⅱ。
反应的程度,进行实验Ⅱ。
a.按下图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。
偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
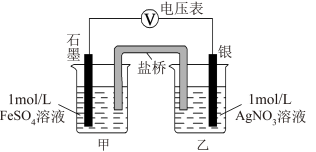
①a中甲烧杯里的电极反应式是___________ 。
②b中电压表指逆向偏移后,银为极___________ (填“正”或“负”)。
③由实验得出 和
和 反应的离子方程式是
反应的离子方程式是___________ 。
 和
和 反应的程度,进行以下实验。已知:相关物质的
反应的程度,进行以下实验。已知:相关物质的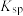 (25℃) AgCl:
(25℃) AgCl:
 :
:
(1)甲同学的实验如下:
序号 | 操作 | 现象 |
实验1 | 将2mL | 产生白色沉淀,随后有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是
②甲同学得出
 氧化了
氧化了 的依据是
的依据是(2)乙同学为探究
 和
和 反应的程度,进行实验Ⅱ。
反应的程度,进行实验Ⅱ。a.按下图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。
偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓
 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是
②b中电压表指逆向偏移后,银为极
③由实验得出
 和
和 反应的离子方程式是
反应的离子方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】完成下列问题。
I.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
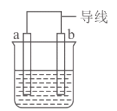
(1)当电极a为Al、电极b为Cu、电解质溶液为浓硝酸时,正极的电极反应式为_____ ,当电路中有0.2mol电子通过时,负极的质量减少_____ g。当电解质溶液为氢氧化钠溶液时,该装置负极的电极反应式为:_____ 。
II.X、Y、Z是同主族的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>HYO4>HZO4。则下列说法正确的是
(2)原子半径:_____ 。
(3)元素的非金属性:_____ 。
(4)气态氢化物稳定性:_____ 。
I.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。

(1)当电极a为Al、电极b为Cu、电解质溶液为浓硝酸时,正极的电极反应式为
II.X、Y、Z是同主族的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>HYO4>HZO4。则下列说法正确的是
(2)原子半径:
(3)元素的非金属性:
(4)气态氢化物稳定性:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】反应Sn+H2SO4=SnSO4+H2↑的能量变化趋势,如图所示:
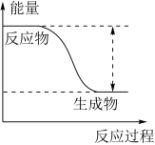
(1)该反应为_______ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
(3)若将上述反应设计成原电池,石墨棒为原电池某一极材料,则石墨棒为_______ 极(填“正”或“负”)。石墨棒上产生的现象为_______ ,该极上发生的电极反应为_______ ,原电池工作时溶液中的 移向
移向_______ 极移动(填正或负)。
(4)实验后同学们经过充分讨论,观察原电池反应特点,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是_______ 。
A.CO2+H2O=H2CO3 B.NaOH+HCl=NaCl+H2O C.2H2+O2=2H2O D.CuO+H2SO4=CuSO4+H2O
以稀硫酸为电解质溶液,在所选反应设计成原电池,该电池负极反应为:_______ 。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
| A.改锡片为锡粉 | B.加入少量醋酸钠固体 |
| C.滴加少量CuSO4 | D.将稀硫酸改为98%的浓硫酸 |
 移向
移向(4)实验后同学们经过充分讨论,观察原电池反应特点,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.CO2+H2O=H2CO3 B.NaOH+HCl=NaCl+H2O C.2H2+O2=2H2O D.CuO+H2SO4=CuSO4+H2O
以稀硫酸为电解质溶液,在所选反应设计成原电池,该电池负极反应为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氧、硫、硒( )、碲(
)、碲( )、钋(
)、钋(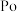 )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ 。
(2)某温度时,该族单质与 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下:
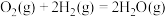

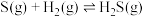


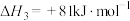
①硫和硒的氢化物的热稳定性:H2S_____ H2Se (填>、=或<);用原子结构知识解释你的判断结果_______ 。
②写出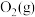 与
与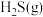 反应生成
反应生成 和
和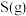 的热化学方程式
的热化学方程式_______ 。
(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为_______ 。
②生物浸出时的总反应的氧化剂是_______ 。
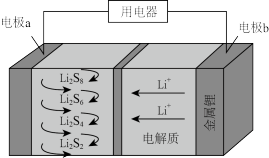
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: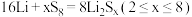 。下列说法
。下列说法错误 的是_______
 )、碲(
)、碲( )、钋(
)、钋(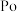 )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:(1)
 在周期表中的位置为
在周期表中的位置为(2)某温度时,该族单质与
 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下: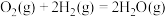

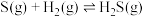


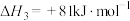
①硫和硒的氢化物的热稳定性:H2S
②写出
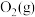 与
与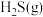 反应生成
反应生成 和
和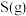 的热化学方程式
的热化学方程式(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为
②生物浸出时的总反应的氧化剂是
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极
 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: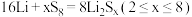 。下列说法
。下列说法
A.电池工作时,正极可发生反应: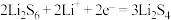 |
B.电池工作时,外电路中流过 电子,负极材料减重 电子,负极材料减重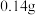 |
C.石墨烯的作用主要是提高电极 的导电性 的导电性 |
D.电池充电时间越长,电池中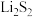 的量越多 的量越多 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】(1)抽烟对人体有害,烟草不完全燃烧产生的CO被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生反应:CO+HbO2⇌O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
①上述反应的平衡常数表达式为K=_____________________ 。
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。已知37℃时,平衡常数K=220,这时HbCO的浓度__________ HbO2浓度的0.02倍(填“大于”“等于”、或“小于”)。
(2)把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是________ 和__________ 。(填序号“I”“II”“III”或“IV”)

(3)一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)

根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=___________ ,升高温度,K值 ________________ 。(填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=_____________ 。
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是
,下列有关该体系的说法正确的是__________
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时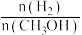 增大
增大
①上述反应的平衡常数表达式为K=
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。已知37℃时,平衡常数K=220,这时HbCO的浓度
(2)把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是

(3)一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)

根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
 ,下列有关该体系的说法正确的是
,下列有关该体系的说法正确的是a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时
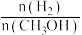 增大
增大
您最近一年使用:0次

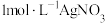 溶液加入到
溶液加入到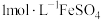 溶液中
溶液中

