完成下列问题。
I.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
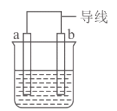
(1)当电极a为Al、电极b为Cu、电解质溶液为浓硝酸时,正极的电极反应式为_____ ,当电路中有0.2mol电子通过时,负极的质量减少_____ g。当电解质溶液为氢氧化钠溶液时,该装置负极的电极反应式为:_____ 。
II.X、Y、Z是同主族的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>HYO4>HZO4。则下列说法正确的是
(2)原子半径:_____ 。
(3)元素的非金属性:_____ 。
(4)气态氢化物稳定性:_____ 。
I.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。

(1)当电极a为Al、电极b为Cu、电解质溶液为浓硝酸时,正极的电极反应式为
II.X、Y、Z是同主族的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>HYO4>HZO4。则下列说法正确的是
(2)原子半径:
(3)元素的非金属性:
(4)气态氢化物稳定性:
更新时间:2022-12-20 12:56:09
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 等气体污染环境,电化学技术可以将
等气体污染环境,电化学技术可以将 “变废为宝”,是有效解决该问题的重要方法。
“变废为宝”,是有效解决该问题的重要方法。
(1)某兴趣小组以 为原料,采用电化学方法制取较高浓度的硫酸。装置示意图如下:
为原料,采用电化学方法制取较高浓度的硫酸。装置示意图如下:

①电子的流向:电极M___________ 电极N(填“ ”或“
”或“ ”);
”);
②M极上的电极反应式为___________ ;
③一段时间后,小组成员测得离子交换膜X右侧硫酸溶液的浓度不变,则离子交换膜X为___________ 交换膜(填“阳离子”或“阴离子”)。
(2)某工厂烟气中主要含有 ,可用NaOH溶液吸收烟气中的
,可用NaOH溶液吸收烟气中的 ,将所得的
,将所得的 溶液进行电解,在循环再生NaOH的同时,可得到
溶液进行电解,在循环再生NaOH的同时,可得到 ,其原理如图所示(电极材料为石墨):
,其原理如图所示(电极材料为石墨):

①图中所产生的物质A为___________ ;
②右室(阴离子交换膜右侧)中加入稀硫酸的主要目的是___________ ;
③当左室(阳离子交换膜左侧)增加的阴离子数目为2 时,有
时,有___________ mol 通过阴离子交换膜。
通过阴离子交换膜。
 等气体污染环境,电化学技术可以将
等气体污染环境,电化学技术可以将 “变废为宝”,是有效解决该问题的重要方法。
“变废为宝”,是有效解决该问题的重要方法。(1)某兴趣小组以
 为原料,采用电化学方法制取较高浓度的硫酸。装置示意图如下:
为原料,采用电化学方法制取较高浓度的硫酸。装置示意图如下:
①电子的流向:电极M
 ”或“
”或“ ”);
”);②M极上的电极反应式为
③一段时间后,小组成员测得离子交换膜X右侧硫酸溶液的浓度不变,则离子交换膜X为
(2)某工厂烟气中主要含有
 ,可用NaOH溶液吸收烟气中的
,可用NaOH溶液吸收烟气中的 ,将所得的
,将所得的 溶液进行电解,在循环再生NaOH的同时,可得到
溶液进行电解,在循环再生NaOH的同时,可得到 ,其原理如图所示(电极材料为石墨):
,其原理如图所示(电极材料为石墨):
①图中所产生的物质A为
②右室(阴离子交换膜右侧)中加入稀硫酸的主要目的是
③当左室(阳离子交换膜左侧)增加的阴离子数目为2
 时,有
时,有 通过阴离子交换膜。
通过阴离子交换膜。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中。
(1)砷化氢的电子式为________ ,其稳定性比NH3______ (填“强”或“弱”)。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是一种两性氧化物,写出As2O3溶于浓盐酸的化学方程式__________ 。
(3)冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知:I.As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2
2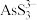 (aq);
(aq);
II.亚砷酸盐的溶解性大于相应砷酸盐。
①“一级沉砷”中FeSO4的作用是___________________________ ;
②“二级沉砷”中H2O2作_____ 剂(填“氧化”或“还原”);沉淀X为_____ (填化学式)。
(4)已知砷酸(H3AsO4)是三元酸,有较强的氧化性。
①常温下砷酸的Ka1=6×10-3、Ka2=1×10-7,则 NaH2AsO4溶液中c( )
)____ c(H3AsO4)(填“>”、“<”或“=”)。
②某原电池装置如图所示,C1、C2为两个石墨电极,电池总反应为:
 +2I-+H2O
+2I-+H2O
 +I2+2OH-。
+I2+2OH-。

当A池中溶液由无色变成蓝色时,正极上的电极反应式为_____________ 。
当电流计指针归中后向B池中加入一定量的NaOH,则电子由____ (填“C1”或“C2”)流出。
(1)砷化氢的电子式为
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是一种两性氧化物,写出As2O3溶于浓盐酸的化学方程式
(3)冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:I.As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2
2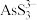 (aq);
(aq);II.亚砷酸盐的溶解性大于相应砷酸盐。
①“一级沉砷”中FeSO4的作用是
②“二级沉砷”中H2O2作
(4)已知砷酸(H3AsO4)是三元酸,有较强的氧化性。
①常温下砷酸的Ka1=6×10-3、Ka2=1×10-7,则 NaH2AsO4溶液中c(
 )
)②某原电池装置如图所示,C1、C2为两个石墨电极,电池总反应为:
 +2I-+H2O
+2I-+H2O
 +I2+2OH-。
+I2+2OH-。
当A池中溶液由无色变成蓝色时,正极上的电极反应式为
当电流计指针归中后向B池中加入一定量的NaOH,则电子由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】I.某研究性学习小组的同学对Zn、Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用如图 所示装置进行探究,乙同学经过查阅资料后设计了图
所示装置进行探究,乙同学经过查阅资料后设计了图 装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。

(1)实验表明,图 中铜电极上有气泡产生,说明反应中有一部分化学能转化为
中铜电极上有气泡产生,说明反应中有一部分化学能转化为_______ 能。锌电极为_______ 极(填写“正”或“负”),电极反应为:_______ 。
(2)图 中实验过程中只有
中实验过程中只有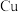 极上产生气泡,则
极上产生气泡,则 是
是_______ 溶液,正极上的电极反应式为_______ 。
(3)当图 装置中的溶液质量增加
装置中的溶液质量增加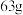 时,生成氢气
时,生成氢气_______ L(标准状况);当图 中锌电极的质量减少
中锌电极的质量减少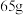 时,电路中转移的电子为
时,电路中转移的电子为_______ 
II.已知反应:
(4)已知下列数据:
若反应生成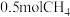
_______ (释放或者吸收)_______ 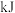 能量。
能量。
(5)在一定温度下,向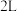 密闭容器中充入
密闭容器中充入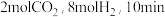 达到平衡,平衡时,测得
达到平衡,平衡时,测得 的体积分数为
的体积分数为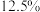 。
。 内,
内, 的平均反应速率为
的平均反应速率为_______ ,平衡时 的转化率为
的转化率为_______ 。
 所示装置进行探究,乙同学经过查阅资料后设计了图
所示装置进行探究,乙同学经过查阅资料后设计了图 装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
(1)实验表明,图
 中铜电极上有气泡产生,说明反应中有一部分化学能转化为
中铜电极上有气泡产生,说明反应中有一部分化学能转化为(2)图
 中实验过程中只有
中实验过程中只有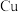 极上产生气泡,则
极上产生气泡,则 是
是(3)当图
 装置中的溶液质量增加
装置中的溶液质量增加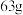 时,生成氢气
时,生成氢气 中锌电极的质量减少
中锌电极的质量减少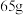 时,电路中转移的电子为
时,电路中转移的电子为
II.已知反应:

(4)已知下列数据:
| 化学键 |  |  | 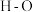 |  |
| 断裂化学键吸收的能量kJ/mol |  | 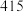 |  | 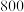 |
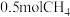
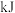 能量。
能量。(5)在一定温度下,向
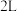 密闭容器中充入
密闭容器中充入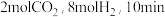 达到平衡,平衡时,测得
达到平衡,平衡时,测得 的体积分数为
的体积分数为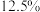 。
。 内,
内, 的平均反应速率为
的平均反应速率为 的转化率为
的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
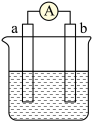
 当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为
当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为___________ 。当电路中有1moL e-通过时,两极板的质量差为___________ g
 当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为
当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为___________ 。当反应中收集到标准状况下336mL气体时,消耗的电极的物质的量为___________ moL。
 燃料电池的工作原理是将燃料和氧化剂
燃料电池的工作原理是将燃料和氧化剂 如
如 反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入
反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入___________ 极 填“a”或“b”
填“a”或“b” ,该电极反应式为
,该电极反应式为___________ ,电解质溶液中 向
向___________ 极移动(填“a”或“b”)。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Fe + 2Fe3+=3Fe2+”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液___________ 。


 当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为
当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为 当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为
当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为 燃料电池的工作原理是将燃料和氧化剂
燃料电池的工作原理是将燃料和氧化剂 如
如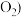 反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入
反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入 填“a”或“b”
填“a”或“b” ,该电极反应式为
,该电极反应式为 向
向(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Fe + 2Fe3+=3Fe2+”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】X、Y、Z、M、Q、R是六种短周期主族元素,其原子半径及主要化合价如下表所示:
(1)X、Y、Z的简单离子中,离子半径最小的是______ (填离子符号),R与Q按原子个数比为1:1形成的化合物T属于___________ 化合物(填“离子"或“共价”)。
(2)化合物T与化合物YQ2反应的化学方程式为:__________________________ 。
(3)Y、M两种元素相比较非金属性较强的是_______ (填元素符号),下列事实能证明这一结论的是______ (选填字母序号)。
a.简单气态氢化物的热稳定性:M> Y b. Y与M形成的化合物中Y呈正价
c. 常温下Y的单质呈固态,M的单质呈气态 d.简单氢化物的水溶液酸性;M>Y
e.含氧酸的酸性:HMO3> H2YO3
(4)以X、Z为电极材料,R的最高价氧化物对应的水化物为电解质溶液,将两电极用导线相连插入该电解质溶液中可形成原电池,该电池中正极材料为_______ (填材料名称),负极反应式为___________________________________ 。
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.102 | 0.143 | 0.099 | 0.074 | 0.186 |
| 主要化合价 | +2 | +6、-2 | +3 | +7、-1 | -2 | + 1 |
(2)化合物T与化合物YQ2反应的化学方程式为:
(3)Y、M两种元素相比较非金属性较强的是
a.简单气态氢化物的热稳定性:M> Y b. Y与M形成的化合物中Y呈正价
c. 常温下Y的单质呈固态,M的单质呈气态 d.简单氢化物的水溶液酸性;M>Y
e.含氧酸的酸性:HMO3> H2YO3
(4)以X、Z为电极材料,R的最高价氧化物对应的水化物为电解质溶液,将两电极用导线相连插入该电解质溶液中可形成原电池,该电池中正极材料为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
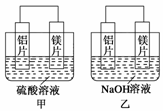
(1)写出甲中正极的电极反应式___________________ 。
(2)乙中总反应的离子方程式:________________________ 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__________ 活动性更强,而乙会判断出_____________ 活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有______________ 。

(1)写出甲中正极的电极反应式
(2)乙中总反应的离子方程式:
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验得出的下列结论中,正确的有
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】X、Y、Z、W、R、T为核电荷数依次增大的前4周期主族元素,X与Y、Z与W均为同周期相邻元素,W、T同主族;Y元素最外层电子数是内层电子数的3倍,Z元素形成的简单离子半径在同周期中最小,R元素最外层电子数等于X的质子数。回答下列问题:
(1)W的元素符号为_______ ,Z元素的离子结构示意图为_______ 。
(2)X元素原子的得电子能力_______ (填“强”或“弱”)于Y,请用原子结构的知识解释原因_______ 。
(3)实验室制备R元素单质的离子方程式为_______ 。
(4)X的气态氢化物与R的气态氢化物可以发生反应,其反应产物的电子式为_______ 。
(5)T在元素周期表中的位置为_______ ,W、T的简单气态氢化物的稳定性较强的是_______ (填氢化物化学式)。
(1)W的元素符号为
(2)X元素原子的得电子能力
(3)实验室制备R元素单质的离子方程式为
(4)X的气态氢化物与R的气态氢化物可以发生反应,其反应产物的电子式为
(5)T在元素周期表中的位置为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物 浓度均为
浓度均为 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

 元素R在周期表中的位置是
元素R在周期表中的位置是______ ;元素Z的原子结构示意图是______ 。
 元素Y和W形成的
元素Y和W形成的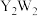 型化合物中含有化学键的类型为
型化合物中含有化学键的类型为______ 。
 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如 、
、 、COS等。
、COS等。
 下列能说明碳、硫两种元素非金属性相对强弱的是
下列能说明碳、硫两种元素非金属性相对强弱的是______  填序号
填序号
A.S与 发生化合反应比C与
发生化合反应比C与 化合更容易
化合更容易
B.酸性:
C. 中碳元素为
中碳元素为 价,硫元素为
价,硫元素为 价
价
 铅
铅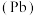 、锡
、锡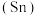 、锗
、锗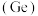 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
 锗的原子序数为
锗的原子序数为______ 。
 它们
它们 价氢氧化物的碱性由强到弱顺序为
价氢氧化物的碱性由强到弱顺序为______  填化学式
填化学式 。
。
 羰基硫
羰基硫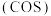 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和 相似。
相似。
 用电子式表示羰基硫
用电子式表示羰基硫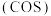 的形成过程:
的形成过程:______ 。
 羰基硫
羰基硫 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:
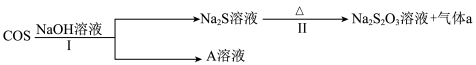
已知A是一种正盐,则A的化学式为______ ;若气体a为单质,反应II的离子方程式为______ 。
I.部分短周期主族元素的最高价氧化物对应的水化物
 浓度均为
浓度均为 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。
 元素R在周期表中的位置是
元素R在周期表中的位置是 元素Y和W形成的
元素Y和W形成的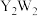 型化合物中含有化学键的类型为
型化合物中含有化学键的类型为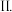 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如 、
、 、COS等。
、COS等。 下列能说明碳、硫两种元素非金属性相对强弱的是
下列能说明碳、硫两种元素非金属性相对强弱的是 填序号
填序号
A.S与
 发生化合反应比C与
发生化合反应比C与 化合更容易
化合更容易B.酸性:

C.
 中碳元素为
中碳元素为 价,硫元素为
价,硫元素为 价
价 铅
铅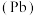 、锡
、锡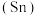 、锗
、锗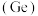 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论: 锗的原子序数为
锗的原子序数为 它们
它们 价氢氧化物的碱性由强到弱顺序为
价氢氧化物的碱性由强到弱顺序为 填化学式
填化学式 。
。 羰基硫
羰基硫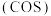 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和 相似。
相似。 用电子式表示羰基硫
用电子式表示羰基硫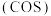 的形成过程:
的形成过程: 羰基硫
羰基硫 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图: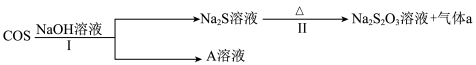
已知A是一种正盐,则A的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】今年是门捷列夫发现元素周期律151周年。下表是元素周期表的一部分。

请根据要求回答下列问题:
(1)1934年居里夫妇用α粒子轰击静止的e得到产物X,开创了人造核素的先河,其核反应为: ,则X的核素符号为
,则X的核素符号为___________ 。
(2)e的氢氧化物与碳酸钠一起溶于氢氟酸中,可以得到电解法制e单质所需要的助熔剂冰晶石(Na3AlF6),同时产生温室气体,写出该方法制得冰晶石的化学方程式:___________ 。
(3)d、g、f的最简单氢化物中稳定性最差的是___________ (填化学式)。
(4)已知反应4ah(g)+d2(g)=2a2d(g)+2h2(g),其中各物质含有的化学键键能如下表所示:
则该反应是___________ (填“放热”或“吸热”)反应。
(5)a与c可以形成多种化合物。
①写出a与c形成的最简单烯烃的电子式___________ 。
②ca4可用作燃料,也可形成燃料电池,若ca4与d2以KOH溶液为电解质溶液组成原电池,则该原电池的负极反应式为___________ 。
(6)设计简单实验证明i的非金属性比g强:___________ (任写一种)。

请根据要求回答下列问题:
(1)1934年居里夫妇用α粒子轰击静止的e得到产物X,开创了人造核素的先河,其核反应为:
 ,则X的核素符号为
,则X的核素符号为(2)e的氢氧化物与碳酸钠一起溶于氢氟酸中,可以得到电解法制e单质所需要的助熔剂冰晶石(Na3AlF6),同时产生温室气体,写出该方法制得冰晶石的化学方程式:
(3)d、g、f的最简单氢化物中稳定性最差的是
(4)已知反应4ah(g)+d2(g)=2a2d(g)+2h2(g),其中各物质含有的化学键键能如下表所示:
| 化学键 | a-b | d=d | a-d | h-h |
| 键能/(kJ/mol) | 431 | 498 | 464 | 243 |
(5)a与c可以形成多种化合物。
①写出a与c形成的最简单烯烃的电子式
②ca4可用作燃料,也可形成燃料电池,若ca4与d2以KOH溶液为电解质溶液组成原电池,则该原电池的负极反应式为
(6)设计简单实验证明i的非金属性比g强:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
(1)元素⑦在元素周期表位置是________________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)。________________________
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)_______________ 。
(4)由①和④组成的元素质重比为1:8的化合物的电子式是_________ 。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为。______________________________
① | ||||||
② | ③ | ④ | ||||
⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)。
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)
(4)由①和④组成的元素质重比为1:8的化合物的电子式是
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】随着原子序数的递增,8种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
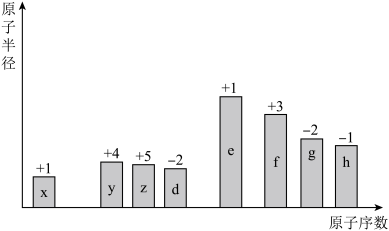
请用化学用语回答下列问题:
(1)f在元素周期表中的位置是_______ 。
(2)比较d、e常见离子的半径,半径大的是:_______ (用化学式表示,下同);g、h的最高价氧化物的水化物中酸性强的是:_______ 。
(3)d、g的单质分别与x的单质化合时,较容易的是_______ (用化学式表示,下同),形成的化合物热稳定性较差的是_______ 。x2d、x2g沸点较高的是_______ ,原因是_______ 。
(4)任选上述元素形成一种四原子共价化合物,写出其电子式:_______ 。

请用化学用语回答下列问题:
(1)f在元素周期表中的位置是
(2)比较d、e常见离子的半径,半径大的是:
(3)d、g的单质分别与x的单质化合时,较容易的是
(4)任选上述元素形成一种四原子共价化合物,写出其电子式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】现有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1) 的电子式为
的电子式为____ 。(A、C为字母代号,请将字母代号用元素符号表示,下同)
(2) 元素的基态原子核外共有
元素的基态原子核外共有_______ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈_______ 形。
(3) 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是_______ 。
(4) 位于元素周期表中
位于元素周期表中_______ 区(按电子排布分区),其基态原子的价层电子排布式为_______ ,实验室用一种黄色溶液检验 时产生的蓝色沉淀的化学式为
时产生的蓝色沉淀的化学式为_______ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
 元素是形成化合物种类最多的元素 元素是形成化合物种类最多的元素 |
 元素基态原子的核外 元素基态原子的核外 能级电子数比 能级电子数比 能级电子数少1个 能级电子数少1个 |
 元素基态原子的核外 元素基态原子的核外 轨道中有两个未成对电子 轨道中有两个未成对电子 |
 元素的气态基态原子的第一至第四电离能分别是: 元素的气态基态原子的第一至第四电离能分别是: , ,  , , |
 元素的主族序数与周期数的差为4 元素的主族序数与周期数的差为4 |
 元素是前四周期中电负性最小的元素 元素是前四周期中电负性最小的元素 |
 元素位于元素周期表中的第8列 元素位于元素周期表中的第8列 |
 的电子式为
的电子式为(2)
 元素的基态原子核外共有
元素的基态原子核外共有(3)
 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是(4)
 位于元素周期表中
位于元素周期表中 时产生的蓝色沉淀的化学式为
时产生的蓝色沉淀的化学式为
您最近一年使用:0次



