工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。其中的关键反应是硫酸钠和焦炭、石灰石的反应,其反应的化学方程式为:_______ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
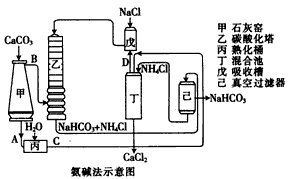
①用化学式表示出图中的中间产物C是_______ ,D是_______ ;
②装置乙中发生反应的化学方程式为_______ ;
(3)联合制碱法是对氨碱法的改进,其优点是(不低于2条)_______ 。
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行___________ ?

(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。其中的关键反应是硫酸钠和焦炭、石灰石的反应,其反应的化学方程式为:
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。

①用化学式表示出图中的中间产物C是
②装置乙中发生反应的化学方程式为
(3)联合制碱法是对氨碱法的改进,其优点是(不低于2条)
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行

更新时间:2021-08-16 10:03:09
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】三氯化硼(BCl3),主要用作半导体硅的掺杂源或有机合成催化剂,还用于高纯硼或有机硼的制取。某兴趣小组用氯气和硼为原料,采用下列装置(部分装置可重复使用)制备BCl3。


已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;遇水剧烈反应生成硼酸和盐酸;②2B+6HCl 2BCl3+3H2;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3+3H2;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
请回答下列问题:
(1)A装置可用氯酸钾固体与浓盐酸反应制取氯气,反应的化学方程式为___________ 。
(2)装从左到右的接口连接顺序为a→___________ →j。
(3)装置E中的试剂为___________ ,作用是___________ 。如果拆去E装置,可能的后果是___________ 。
(4)NaOH的作用是___________ ,B中冰水的作用是___________ 。
(5)D装置中发生反应前先通入一段时间的氯气,排尽装置中的空气。若缺少此步骤,则造成的结果是___________ 。


已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;遇水剧烈反应生成硼酸和盐酸;②2B+6HCl
 2BCl3+3H2;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3+3H2;③硼与铝的性质相似,也能与氢氧化钠溶液反应。请回答下列问题:
(1)A装置可用氯酸钾固体与浓盐酸反应制取氯气,反应的化学方程式为
(2)装从左到右的接口连接顺序为a→
(3)装置E中的试剂为
(4)NaOH的作用是
(5)D装置中发生反应前先通入一段时间的氯气,排尽装置中的空气。若缺少此步骤,则造成的结果是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。回答下列问题:
Ⅰ、工业生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:

(1)上述流程中“碱浸”后,物质A必须经过___________ (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为___________ 。
(2)上述流程中采用稀碱液比用热水更好,理由是___________ 。
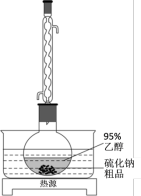
Ⅱ、工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。
(3)溶解回流装置如图所示,回流前无需加入沸石,其原因是___________ 。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的 。若气雾上升过高,可采取的措施是
。若气雾上升过高,可采取的措施是___________ 。
(4)回流时间不宜过长,原因是___________ 。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为___________ (填标号)。
a.①②③ b.③①② c.②①③ d.①③②
(5)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是___________ 。过滤除去的杂质为___________ 。若滤纸上析出大量晶体,则可能的原因是___________ 。
Ⅲ、应用
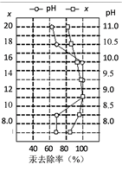
(6)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是___________ 、___________ 。
(7)某毛纺厂废水中含0.001mol·L-1的硫化钠,与纸张漂白后的废水(含0.002mol·L-1NaClO)按1∶2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有___________ 。
Ⅰ、工业生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:

(1)上述流程中“碱浸”后,物质A必须经过
(2)上述流程中采用稀碱液比用热水更好,理由是

Ⅱ、工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。
(3)溶解回流装置如图所示,回流前无需加入沸石,其原因是
 。若气雾上升过高,可采取的措施是
。若气雾上升过高,可采取的措施是(4)回流时间不宜过长,原因是
a.①②③ b.③①② c.②①③ d.①③②
(5)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是
Ⅲ、应用
(6)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是

(7)某毛纺厂废水中含0.001mol·L-1的硫化钠,与纸张漂白后的废水(含0.002mol·L-1NaClO)按1∶2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】氮及其化合物在生产生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
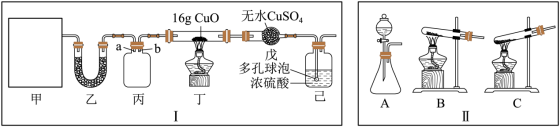
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证 具有还原性,请回答下列问题:
具有还原性,请回答下列问题:
(1)实验室制备氨气有多种方法,现欲用 与熟石灰反应制取
与熟石灰反应制取 ,则甲中的气体发生装置为
,则甲中的气体发生装置为_______ (从Ⅱ中选用)。
(2)装置丙用于收集 ,应将导管
,应将导管_______ (填“a”或“b”)延长至集气瓶底部,装置乙中盛放的试剂为_______ 。
Ⅱ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
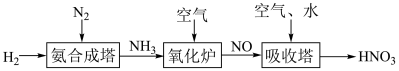
(3)氨气在“氧化炉”中所发生反应的化学方程式_______ 。
(4)“吸收塔”尾部会有含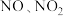 等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下三种方法处理:
等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下三种方法处理:
①纯碱溶液吸收法。请用离子方程式表示纯碱吸收 的反应原理:
的反应原理:_______ 。
②氨转化法。已知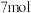 氨恰好能将含
氨恰好能将含 和
和 共
共 的混合气体完全转化为
的混合气体完全转化为 ,则混合气体中
,则混合气体中 和
和 的物质的量之比
的物质的量之比_______ 。
③臭氧脱硝法: 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和氧气,该反应的化学方程式为
和氧气,该反应的化学方程式为_______ 。
Ⅲ.国家规定地下水中氨氧化物的排放标准不超过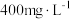 。氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为
。氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为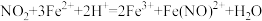 。现测定某地下水脱硝过程中氦氧化物的排放量:收集
。现测定某地下水脱硝过程中氦氧化物的排放量:收集 排放的气体,缓慢通过
排放的气体,缓慢通过 酸性
酸性 溶液(过量),充分反应,量取吸收气体的溶液置于锥形瓶中,用
溶液(过量),充分反应,量取吸收气体的溶液置于锥形瓶中,用 酸性溶液反应过量的
酸性溶液反应过量的 (还原产物为
(还原产物为 ),重复上述实验操作3次,平均消耗酸性溶液的体积为
),重复上述实验操作3次,平均消耗酸性溶液的体积为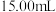 。
。
(5)试通过计算分析地下水脱硝过程中氮氧化物(以 进行计算)的排放是否符合国家标准
进行计算)的排放是否符合国家标准_______ 。(已知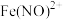 与酸性
与酸性 溶液不反应,写出计算过程)
溶液不反应,写出计算过程)
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证
 具有还原性,请回答下列问题:
具有还原性,请回答下列问题:
(1)实验室制备氨气有多种方法,现欲用
 与熟石灰反应制取
与熟石灰反应制取 ,则甲中的气体发生装置为
,则甲中的气体发生装置为(2)装置丙用于收集
 ,应将导管
,应将导管Ⅱ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(3)氨气在“氧化炉”中所发生反应的化学方程式
(4)“吸收塔”尾部会有含
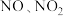 等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下三种方法处理:
等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下三种方法处理:①纯碱溶液吸收法。请用离子方程式表示纯碱吸收
 的反应原理:
的反应原理:②氨转化法。已知
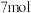 氨恰好能将含
氨恰好能将含 和
和 共
共 的混合气体完全转化为
的混合气体完全转化为 ,则混合气体中
,则混合气体中 和
和 的物质的量之比
的物质的量之比③臭氧脱硝法:
 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和氧气,该反应的化学方程式为
和氧气,该反应的化学方程式为Ⅲ.国家规定地下水中氨氧化物的排放标准不超过
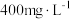 。氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为
。氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为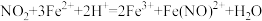 。现测定某地下水脱硝过程中氦氧化物的排放量:收集
。现测定某地下水脱硝过程中氦氧化物的排放量:收集 排放的气体,缓慢通过
排放的气体,缓慢通过 酸性
酸性 溶液(过量),充分反应,量取吸收气体的溶液置于锥形瓶中,用
溶液(过量),充分反应,量取吸收气体的溶液置于锥形瓶中,用 酸性溶液反应过量的
酸性溶液反应过量的 (还原产物为
(还原产物为 ),重复上述实验操作3次,平均消耗酸性溶液的体积为
),重复上述实验操作3次,平均消耗酸性溶液的体积为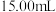 。
。(5)试通过计算分析地下水脱硝过程中氮氧化物(以
 进行计算)的排放是否符合国家标准
进行计算)的排放是否符合国家标准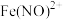 与酸性
与酸性 溶液不反应,写出计算过程)
溶液不反应,写出计算过程)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】食盐是一种与人类生活最密切的物质之一。以食盐为原料可以制取金属钠、氯气、氢气、烧碱等宝贵的化学用品和化工原料。
(1)写出工业制备金属钠的化学方程式:________ 。
(2)电解________ 可制得烧碱、氢气和氯气,这称为________ 工业。写出该工业中的电极反应式及总反应式:阳极_________ ;阴极________ ;总反应式________ 。
(3)我国著名的化工专家侯德榜发明的“联合制碱”法也以食盐为基础原料,该方法为先向饱和食盐水中通入 ,再通入
,再通入 气体,析出
气体,析出 晶体,化学方程式为
晶体,化学方程式为________ ;将析出的 晶体灼烧即得纯碱,化学方程式为
晶体灼烧即得纯碱,化学方程式为___________ 。
(1)写出工业制备金属钠的化学方程式:
(2)电解
(3)我国著名的化工专家侯德榜发明的“联合制碱”法也以食盐为基础原料,该方法为先向饱和食盐水中通入
 ,再通入
,再通入 气体,析出
气体,析出 晶体,化学方程式为
晶体,化学方程式为 晶体灼烧即得纯碱,化学方程式为
晶体灼烧即得纯碱,化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】“索尔维制碱法”工艺流程如图所示,请回答下列问题:

(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO和Fe2O3,若某α-Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比为___________________ ;
(2)向饱和NaCl溶液中先通入___________ 气体,效果更好。反应制得NaHCO3沉淀和NH4Cl溶液的化学程式为______________________
(3)索尔维制碱法除了得到纯碱外,还会产生一种废渣________ 。侯氏制碱法在此工业上改进,不再使用CaCO3制备CO2,而是在制备NH3的过程中制得CO2,则侯氏制碱法在得到纯碱的同时还制得了____________ ,此物质在农业上的用途是______________ 。

(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO和Fe2O3,若某α-Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比为
(2)向饱和NaCl溶液中先通入
(3)索尔维制碱法除了得到纯碱外,还会产生一种废渣
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“苏氏三兄弟”,它们在生活、生产中有广泛应用。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式___ ,操作时,往饱和食盐水中先通入气体,先制备小苏打的原因是___ 。
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因__ 。
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是__ 。
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式__ 。Na2S溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式为__ 。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时 满足的条件是
满足的条件是__ 。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时
 满足的条件是
满足的条件是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】烟花爆竹常常在重大节日庆典中燃放。烟花的主要成分可以分成氧化剂、还原剂、发色剂、黏合剂等。
(1)爆竹的主要成分是黑火药,含有硝酸钾、硫黄和木炭。生成物中有一种单质,该单质分子的电子式是___________ 。
(2)用高氯酸钾代替硝酸钾,用糖类代替木炭和硫黄,可避免硫化钾、二氧化硫等有害物质的排放。请写出高氯酸钾(KClO4)与葡萄糖(C6H12O6)反应的化学方程式:___________ 。
(3)烟花中的发光剂,可用短周期金属的粉末,其燃烧时会发出白炽的强光。写出该金属的化学符号___________ 。
(4)烟花中还含有发色剂,利用焰色反应可使烟花放出五彩缤纷的色彩。焰色反应的原理是___________ 。
(1)爆竹的主要成分是黑火药,含有硝酸钾、硫黄和木炭。生成物中有一种单质,该单质分子的电子式是
(2)用高氯酸钾代替硝酸钾,用糖类代替木炭和硫黄,可避免硫化钾、二氧化硫等有害物质的排放。请写出高氯酸钾(KClO4)与葡萄糖(C6H12O6)反应的化学方程式:
(3)烟花中的发光剂,可用短周期金属的粉末,其燃烧时会发出白炽的强光。写出该金属的化学符号
(4)烟花中还含有发色剂,利用焰色反应可使烟花放出五彩缤纷的色彩。焰色反应的原理是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】CaCN2曾经直接用作肥料。在自然界中,它与水反应产生肥料,在此过程中会涉及到下面一些步骤:
第一步水解,CaCN2与H2O以1:1(物质的量比)反应,生成两种中间体A和B,它们都是含钙的离子化合物,这步反应可以描述为简单的酸碱反应。化合物A和B在热力学上不稳定,受热很容易分解。
化合物A热分解生成离子化合物C和共价化合物D,A与CO2反应,生成共价化合物D和新的离子化合物E。E热分解得到化合物C和CO2。化合物B与CO2、H2O反应生成E和新的共价化合物F,F简单水解(以1:1物质的量比),产生共价化合物G;G常用作肥料,G彻底水解生成CO2和另一种气体H。试回答下列问题:
(1)试画出CaCN2中阴离子的共振结构式与共轭结构式:___ 、___ 。
(2)试写出字母A~H所代表物质的化学式:A___ 、B___ 、C___ 、D___ 、E___ 、F___ 、G___ 、H___ 。
(3)写出该问题中描述的下列有关反应的化学方程式:
CaCN2与H2O反应:___ ;
化合物A热分解:___ ;
化合物B与CO2、H2O反应___ ;
G彻底水解生成CO2和另一种气体H:___ 。
(4)画出G的Lewis结构式:___ 。
(5)F的结构式是___ ,画出其三种异构体的结构式(不考虑三元环)并命名:___ 。
第一步水解,CaCN2与H2O以1:1(物质的量比)反应,生成两种中间体A和B,它们都是含钙的离子化合物,这步反应可以描述为简单的酸碱反应。化合物A和B在热力学上不稳定,受热很容易分解。
化合物A热分解生成离子化合物C和共价化合物D,A与CO2反应,生成共价化合物D和新的离子化合物E。E热分解得到化合物C和CO2。化合物B与CO2、H2O反应生成E和新的共价化合物F,F简单水解(以1:1物质的量比),产生共价化合物G;G常用作肥料,G彻底水解生成CO2和另一种气体H。试回答下列问题:
(1)试画出CaCN2中阴离子的共振结构式与共轭结构式:
(2)试写出字母A~H所代表物质的化学式:A
(3)写出该问题中描述的下列有关反应的化学方程式:
CaCN2与H2O反应:
化合物A热分解:
化合物B与CO2、H2O反应
G彻底水解生成CO2和另一种气体H:
(4)画出G的Lewis结构式:
(5)F的结构式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】X、Y、Z为周期表前四周期中的常见元素。X的单质是人体呼吸及新陈代谢中必不少的气体。Y的单质也为气体,易溶于水,溶液呈浅黄绿色。Z的基态原子外围电子排布为3d64s2。
(1)将Z2X3与ZY3按等物质的量放在密闭管中加热使其恰好完全反应,只生成一种产物A,其物质的量是反应物的1.5倍。A为菱形片晶,具有金属光泽。此化学反应方程式为___ 。
(2)A不溶于冷水,但在沸水中缓慢水解,生成黄棕色沉淀B,溶液呈酸性,且无气泡产生。取水解后的上层清液,滴入硝酸银溶液,生成白色沉淀,说明Y在A中与___ 是直接相连的,所以水解时Y进入水中。B的化学式为___ 。
(3)将A溶于稀盐酸中,滴入硫氰化铵溶液,星红色,说明A中的Z的氧化数为___ ,A的命名应为___ 。
(1)将Z2X3与ZY3按等物质的量放在密闭管中加热使其恰好完全反应,只生成一种产物A,其物质的量是反应物的1.5倍。A为菱形片晶,具有金属光泽。此化学反应方程式为
(2)A不溶于冷水,但在沸水中缓慢水解,生成黄棕色沉淀B,溶液呈酸性,且无气泡产生。取水解后的上层清液,滴入硝酸银溶液,生成白色沉淀,说明Y在A中与
(3)将A溶于稀盐酸中,滴入硫氰化铵溶液,星红色,说明A中的Z的氧化数为
您最近一年使用:0次



