I.实验室中有一瓶碳酸氢钾固体,因受热而部分变质(杂质为K2CO3,假设杂质分布均匀)。为测定其组成,称取12.76g样品溶于水,配成500mL溶液。取出25.00mL该溶液,加入0.1000mol/LBa(OH)2溶液至60.00mL时沉淀量达到最大。回答下列问题:
(1)写出碳酸氢钾固体受热分解的化学方程式:_______ 。
(2)写出样品溶液与Ba(OH)2溶液反应的离子方程式:_______ 。
(3)12.76g样品中碳酸氢钾物质的量为_______ ,碳酸钾物质的量为_______ 。
II.将Fe2O3和Fe的混合物投入150mL某浓度的稀硫酸中,收集到1.68LH2(标准状况),同时Fe和Fe2O3均无剩余,且加入KSCN后溶液不显血红色,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,测得沉淀的质量为20.25g,共消耗4mol/L的NaOH溶液150mL。(不考虑Fe(OH)2被氧化)
(4)原硫酸的物质的量浓度为_______ 。
(5)原混合物中Fe2O3和Fe的质量分别为多少m(Fe2O3)=_______ ,m(Fe)=_______
(1)写出碳酸氢钾固体受热分解的化学方程式:
(2)写出样品溶液与Ba(OH)2溶液反应的离子方程式:
(3)12.76g样品中碳酸氢钾物质的量为
II.将Fe2O3和Fe的混合物投入150mL某浓度的稀硫酸中,收集到1.68LH2(标准状况),同时Fe和Fe2O3均无剩余,且加入KSCN后溶液不显血红色,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,测得沉淀的质量为20.25g,共消耗4mol/L的NaOH溶液150mL。(不考虑Fe(OH)2被氧化)
(4)原硫酸的物质的量浓度为
(5)原混合物中Fe2O3和Fe的质量分别为多少m(Fe2O3)=
更新时间:2021-08-31 10:54:47
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】海水中有丰富的资源。从海水中可以获得淡水、食盐,并提取溴。回答下列问题。
(1)初步提纯后的粗盐中含有 、
、 、
、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
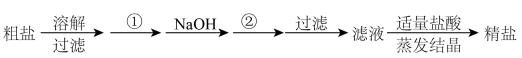
加入的试剂①、②分别是:___________ 、___________ 。
(2)工业上以晒盐后的卤水为原料进行提溴,主要流程如下:
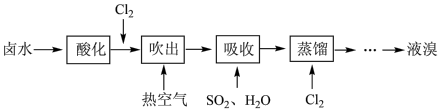
①卤水呈碱性,在通入 前需先酸化,原因是
前需先酸化,原因是___________ 。
②向酸化后的卤水中通入Cl2时主要发生反应的离子方程式为___________ 。
③“吹出”步骤中主要利用了溴的___________ 性。
④设立“吸收”步骤的目的是___________ 。
⑤吸收步骤中发生反应的化学方程式为___________ 。
⑥已知常压下 的沸点是59℃。蒸馏过程中,温度应控制在
的沸点是59℃。蒸馏过程中,温度应控制在___________ (填字母)范围内较合适。
a.20℃~30℃ B.45℃~55℃ C.75℃~85℃ D.100℃~110℃
⑦经该方法处理后, 海水最终得到
海水最终得到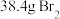 ,若总提取率为60%,则原海水中
,若总提取率为60%,则原海水中 的浓度是
的浓度是___________ 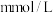 。
。
(1)初步提纯后的粗盐中含有
 、
、 、
、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
加入的试剂①、②分别是:
(2)工业上以晒盐后的卤水为原料进行提溴,主要流程如下:

①卤水呈碱性,在通入
 前需先酸化,原因是
前需先酸化,原因是②向酸化后的卤水中通入Cl2时主要发生反应的离子方程式为
③“吹出”步骤中主要利用了溴的
④设立“吸收”步骤的目的是
⑤吸收步骤中发生反应的化学方程式为
⑥已知常压下
 的沸点是59℃。蒸馏过程中,温度应控制在
的沸点是59℃。蒸馏过程中,温度应控制在a.20℃~30℃ B.45℃~55℃ C.75℃~85℃ D.100℃~110℃
⑦经该方法处理后,
 海水最终得到
海水最终得到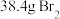 ,若总提取率为60%,则原海水中
,若总提取率为60%,则原海水中 的浓度是
的浓度是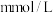 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】某溶液X可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 八种离子中的若干种,为确定其组成,进行如下实验。
八种离子中的若干种,为确定其组成,进行如下实验。
①观察溶液颜色,溶液呈无色,做焰色实验,直接观察时发现焰色为黄色。
②取5mLX溶液,向其中加入 溶液,当沉淀量达到最大时
溶液,当沉淀量达到最大时 也恰好反应完,过滤后将滤渣置于足量盐酸中,充分搅拌后还剩余4.66g干燥固体(Y),将生成的气体全部导入澄清石灰水中,最终得到2g干燥沉淀(Z)。
也恰好反应完,过滤后将滤渣置于足量盐酸中,充分搅拌后还剩余4.66g干燥固体(Y),将生成的气体全部导入澄清石灰水中,最终得到2g干燥沉淀(Z)。
③向步骤②的滤液中加入 溶液得到mg白色沉淀(W)。
溶液得到mg白色沉淀(W)。
(1)由步骤①知,溶液中一定含有的离子是_______ ,一定不存在的离子是_______ 。
(2)由②知,X中含有的离子是_______ ,其中形成Y的源于X溶液的离子物质的量浓度是_______ 。
(3)形成Z的离子方程式为_______ 。
(4)则m的取值范围是:_______ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 八种离子中的若干种,为确定其组成,进行如下实验。
八种离子中的若干种,为确定其组成,进行如下实验。①观察溶液颜色,溶液呈无色,做焰色实验,直接观察时发现焰色为黄色。
②取5mLX溶液,向其中加入
 溶液,当沉淀量达到最大时
溶液,当沉淀量达到最大时 也恰好反应完,过滤后将滤渣置于足量盐酸中,充分搅拌后还剩余4.66g干燥固体(Y),将生成的气体全部导入澄清石灰水中,最终得到2g干燥沉淀(Z)。
也恰好反应完,过滤后将滤渣置于足量盐酸中,充分搅拌后还剩余4.66g干燥固体(Y),将生成的气体全部导入澄清石灰水中,最终得到2g干燥沉淀(Z)。③向步骤②的滤液中加入
 溶液得到mg白色沉淀(W)。
溶液得到mg白色沉淀(W)。(1)由步骤①知,溶液中一定含有的离子是
(2)由②知,X中含有的离子是
(3)形成Z的离子方程式为
(4)则m的取值范围是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】在 浓度为0.5mol/L的某澄清溶液中,还可能含有的离子有K+、Ag+、Mg2+、Ba2+、NO
浓度为0.5mol/L的某澄清溶液中,还可能含有的离子有K+、Ag+、Mg2+、Ba2+、NO 、CO
、CO 、
、 、SO
、SO 。现取该溶液100mL进行如下实验(气体体积均在标准状况下测定):
。现取该溶液100mL进行如下实验(气体体积均在标准状况下测定):
Ⅰ.向该溶液中加入足量稀硝酸,放出0.56L气体;
Ⅱ.向Ⅰ的反应混合液中滴加硝酸银溶液,有白色沉淀生成,将沉淀洗涤、烘干,称量所得固体的质量为2.87g;
Ⅲ.另取10mL原溶液,滴加氯化钡溶液,产生白色沉淀,再加入足量的稀盐酸,沉淀完全溶解。
请回答下列问题:
(1)通过实验Ⅰ能确定一定不存在的离子是___________ (填离子符号)。
(2)实验Ⅱ中生成沉淀的离子方程式为___________ 。
(3)综上所述,填写下表中阴离子的浓度(能计算出的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
(4)判断K+是否存在:___________ (填“存在”或“不存在”);若存在,则其最小浓度为___________ mol/L。
 浓度为0.5mol/L的某澄清溶液中,还可能含有的离子有K+、Ag+、Mg2+、Ba2+、NO
浓度为0.5mol/L的某澄清溶液中,还可能含有的离子有K+、Ag+、Mg2+、Ba2+、NO 、CO
、CO 、
、 、SO
、SO 。现取该溶液100mL进行如下实验(气体体积均在标准状况下测定):
。现取该溶液100mL进行如下实验(气体体积均在标准状况下测定):Ⅰ.向该溶液中加入足量稀硝酸,放出0.56L气体;
Ⅱ.向Ⅰ的反应混合液中滴加硝酸银溶液,有白色沉淀生成,将沉淀洗涤、烘干,称量所得固体的质量为2.87g;
Ⅲ.另取10mL原溶液,滴加氯化钡溶液,产生白色沉淀,再加入足量的稀盐酸,沉淀完全溶解。
请回答下列问题:
(1)通过实验Ⅰ能确定一定不存在的离子是
(2)实验Ⅱ中生成沉淀的离子方程式为
(3)综上所述,填写下表中阴离子的浓度(能计算出的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
| 阴离子 | NO | CO | Cl- | SO |
| c(mol·L-1) | ① | ② | ③ | 0 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】生活离不开化学。家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成分。
①食盐(NaCl) ②料酒(乙醇) ③食醋(乙酸) ④碱面( ) ⑤发酵粉(
) ⑤发酵粉( )和明矾 ⑥84消毒液(NaClO) ⑦洁厕灵(HCl)
)和明矾 ⑥84消毒液(NaClO) ⑦洁厕灵(HCl)
回答下列问题:
(1)氯化钠的摩尔质量为___________ 。
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填正确答案标号)。
(3)明矾的化学式为___________ 。
(4)除去 固体中混有的少量
固体中混有的少量 杂质,应采取的最佳方法是
杂质,应采取的最佳方法是___________ 。
(5)下列性质的比较可以用元素周期律来解释的是___________。
(6)某同学用17 mol⋅L 的浓硫酸配制480 mL 3.4 mol⋅L
的浓硫酸配制480 mL 3.4 mol⋅L 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为___________ (取整数)mL;所配溶液中的 的物质的量浓度为
的物质的量浓度为___________ 。
①食盐(NaCl) ②料酒(乙醇) ③食醋(乙酸) ④碱面(
 ) ⑤发酵粉(
) ⑤发酵粉( )和明矾 ⑥84消毒液(NaClO) ⑦洁厕灵(HCl)
)和明矾 ⑥84消毒液(NaClO) ⑦洁厕灵(HCl)回答下列问题:
(1)氯化钠的摩尔质量为
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填正确答案标号)。
| A.两种物质都是离子晶体 | B.两种物质都是电解质 |
| C.两种物质都是含碳化合物 | D.两种物质都是氧化物 |
(4)除去
 固体中混有的少量
固体中混有的少量 杂质,应采取的最佳方法是
杂质,应采取的最佳方法是(5)下列性质的比较可以用元素周期律来解释的是___________。
| A.同浓度溶液的酸性:乙酸<盐酸 | B.稳定性: |
| C.非金属性:Cl>Br | D.溶液pH:NaCl<84消毒液 |
 的浓硫酸配制480 mL 3.4 mol⋅L
的浓硫酸配制480 mL 3.4 mol⋅L 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】如图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度为___ mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸___ mL。
(3)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填偏高偏低或无影响)?
①未经冷却趁热将溶液注入容量瓶中:___ ;
②定容时仰视读数:___ ;
③用量筒量取浓硫酸时俯视___ ;
④移液时不慎将少量溶液滴在容量瓶外面:___ 。
(4)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应___ ;
②加蒸馏水时不慎超过了刻度,应___ 。
硫酸:化学纯(CP)(500mL)  品名:硫酸 品名:硫酸化学式:H2SO4  相对分子质量:98 相对分子质量:98密度:1.84g/cm-3  质量分数98% 质量分数98% |
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸
(3)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填偏高偏低或无影响)?
①未经冷却趁热将溶液注入容量瓶中:
②定容时仰视读数:
③用量筒量取浓硫酸时俯视
④移液时不慎将少量溶液滴在容量瓶外面:
(4)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应
②加蒸馏水时不慎超过了刻度,应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】I.“皮鞋很忙的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为_______ g。
(2)配制时,下列操作会导致所配溶液浓度偏高的是_______ 。
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。_______ 、_______ 。(填化学式)
A.  B.
B.  C.
C.
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为
(2)配制时,下列操作会导致所配溶液浓度偏高的是
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。
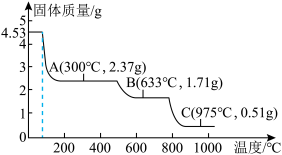
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铝硅合金材料性能优良。铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
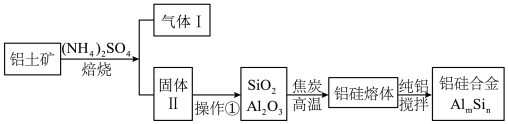
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有_______ 。
(2)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是_______ 。
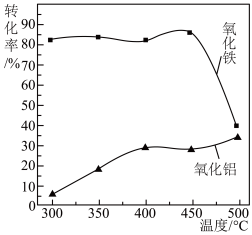
(3)焙烧除铁反应:4(NH4)2SO4+ Fe2O3 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为_______ 。指出气体Ⅰ的用途_______ (任写一种)。
(4)操作①包括:加水溶解、_______ 。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为_______ 。
(5)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式_______ 。

(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有
(2)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是
(3)焙烧除铁反应:4(NH4)2SO4+ Fe2O3
 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为
(4)操作①包括:加水溶解、
(5)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】燃湈、炼钢等过程会产生含有SO2、NO的烟氚,为避免环境污染,研发了多种脱硫脱硝技术。
Ⅰ.活性炭脱硫脱硝技术

(1)吸收塔1,在100-200℃,SO2在活性炭的吸附催化下生成硫酸,该过程的化学方程式为_______ 。
(2)吸收塔2,在活性炭的催化作用下,烟气中的NO转化为无毒无害的气体排放到大气,该过程体现了NH3具有_______ (填“氧化性”或“还原性”)。
(3)吸收塔1中若SO2去除不彻底,进入吸收塔2,会降低NO的去除率,原因是_______ (写化学方程式)。
Ⅱ.络合吸收法脱硝技术,该技术有2种吸收NO的方法,涉及的反应如下:
方法1:
方法2:
已知:[FeY]2-是Fe2+与某有机化合物的阴离子(Y4-)形成的络合物
(4)①方法1,pH过高不利于Fe2+与NO反应,用离子方程式解释原因_______ 。
②尽管生产[FeY]2-所需成本比Fe2+高,实际工业生产更多选用方法2吸收NO,可能的原因有_______ (写出1条即可)。
(5)研究温度对反应 的影响,在相同时间内,测得不同温度下,NO的去除率如图所示,解释随温度变化NO去除率变化的原因
的影响,在相同时间内,测得不同温度下,NO的去除率如图所示,解释随温度变化NO去除率变化的原因_______ 。

Ⅰ.活性炭脱硫脱硝技术

(1)吸收塔1,在100-200℃,SO2在活性炭的吸附催化下生成硫酸,该过程的化学方程式为
(2)吸收塔2,在活性炭的催化作用下,烟气中的NO转化为无毒无害的气体排放到大气,该过程体现了NH3具有
(3)吸收塔1中若SO2去除不彻底,进入吸收塔2,会降低NO的去除率,原因是
Ⅱ.络合吸收法脱硝技术,该技术有2种吸收NO的方法,涉及的反应如下:
方法1:

方法2:

已知:[FeY]2-是Fe2+与某有机化合物的阴离子(Y4-)形成的络合物
(4)①方法1,pH过高不利于Fe2+与NO反应,用离子方程式解释原因
②尽管生产[FeY]2-所需成本比Fe2+高,实际工业生产更多选用方法2吸收NO,可能的原因有
(5)研究温度对反应
 的影响,在相同时间内,测得不同温度下,NO的去除率如图所示,解释随温度变化NO去除率变化的原因
的影响,在相同时间内,测得不同温度下,NO的去除率如图所示,解释随温度变化NO去除率变化的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】对牙膏的探究要用到许多化学知识
(1)下表列出了三种牙膏中的摩擦剂,请在表中填写三种摩擦剂所属的物质类别:
(2)根据你的推测,牙膏摩擦剂在水中的溶解性是___________ (填“易溶”或“难溶”)。
(3)Y牙膏中的摩擦剂——碳酸钙可以用石灰石来制备。某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
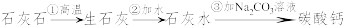
请写出上述方案中有关反应的化学方程式:
①___________ ;
②___________ ;
③___________ ;改写为离子方程式:___________ 。
(4)请你仍用石灰石做原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示的方式,将你的实验方案用流程图表示出来:___________
石灰石→
你设计的方案的优点是___________ 。
(5)检验牙膏中是否含有碳酸钙的实验方法是___________ 。
(1)下表列出了三种牙膏中的摩擦剂,请在表中填写三种摩擦剂所属的物质类别:
| X牙膏 | Y牙膏 | Z牙膏 | |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物) | 两性氢氧化物 | ① | ② |
(3)Y牙膏中的摩擦剂——碳酸钙可以用石灰石来制备。某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
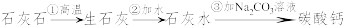
请写出上述方案中有关反应的化学方程式:
①
②
③
(4)请你仍用石灰石做原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示的方式,将你的实验方案用流程图表示出来:
石灰石→
你设计的方案的优点是
(5)检验牙膏中是否含有碳酸钙的实验方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.

已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是__________________ .
(2)C中得到足量KClO后将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为______________ .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
②______________________ ,
③______________________ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由_____________ .
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4﹣+FeO42﹣═Fe(OH)3↓+CrO42﹣+OH﹣;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为:_______________ .
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为:_________________ .计算该K2FeO4样品的纯度为_______________ .

已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是
(2)C中得到足量KClO后将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
②
③
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4﹣+FeO42﹣═Fe(OH)3↓+CrO42﹣+OH﹣;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为:
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】苯甲酸乙酯可用于配制香水香精和人造精油,还可以作为食用香精用于食品中。实验室可用苯甲酸与乙醇为原料制备苯甲酸乙酯,制备装置如图所示(部分装置已省略)。

已知:
制备方法:①在烧瓶C中加入一定量的下列物质。按图甲所示安装好装置,加热烧瓶C,反应一段时间后,停止加热。
②将烧瓶C中的反应液倒入盛有30 mL水的烧杯中,加入Na2CO3,至溶液呈中性。
③用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,二者合并,加入图乙的烧瓶D中,加入沸石并加入无水硫酸镁,加热蒸馏,制得产品2.6 mL。
回答下列问题:
(1)仪器A的名称是________ ,仪器A和仪器B的自来水进水口分别为b口、d口,这种进水方式,冷却效果好,原因是________ 。
(2)环己烷、乙醇与水可形成共沸物,沸点为62.1 ℃。烧瓶C的最佳加热方式是________ ,分水器的“分水”原理是________ ,制备苯甲酸乙酯时,加入的环己烷的作用是________ 。
(3)Na2CO3的作用是________ 。
(4)采用图乙装置进行蒸馏操作,加入无水硫酸镁的目的是________ ,在锥形瓶中,收集________ ℃的馏分。
(5)该制备方法中苯甲酸乙酯的产率是________ 。

已知:
| 物质 | 乙醇 | 苯甲酸 | 环己烷 | 乙醚 | 苯甲酸乙酯 |
| 密度/ (g·cm-3) | 0.789 3 | 1.265 9 | 0.778 5 | 0.731 8 | 1.050 0 |
| 熔点/℃ | -114.0 | 122.1 | 6.5 | -116.3 | -34.6 |
| 沸点/℃ | 78.5 | 249.0 | 80.0 | 34.5 | 211.0~213.0 |
| 物质 | 苯甲酸 | 乙醇 | 环己烷 | 浓硫酸 |
| 用量 | 2.44 g | 15.0 mL | 10.0 mL | 3.0 mL |
③用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,二者合并,加入图乙的烧瓶D中,加入沸石并加入无水硫酸镁,加热蒸馏,制得产品2.6 mL。
回答下列问题:
(1)仪器A的名称是
(2)环己烷、乙醇与水可形成共沸物,沸点为62.1 ℃。烧瓶C的最佳加热方式是
(3)Na2CO3的作用是
(4)采用图乙装置进行蒸馏操作,加入无水硫酸镁的目的是
(5)该制备方法中苯甲酸乙酯的产率是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】硫酸铜主要用作纺织品媒染剂、农业杀虫剂等,其晶体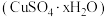 在不同温度下会逐步失去结晶水甚至分解。长郡化学社对硫酸铜晶体受热分解的产物成分进行探究,请回答下列问题:
在不同温度下会逐步失去结晶水甚至分解。长郡化学社对硫酸铜晶体受热分解的产物成分进行探究,请回答下列问题:
I.探究硫酸铜晶体的分解产物
为探究硫酸铜晶体的分解产物,某同学设计了如下实验:
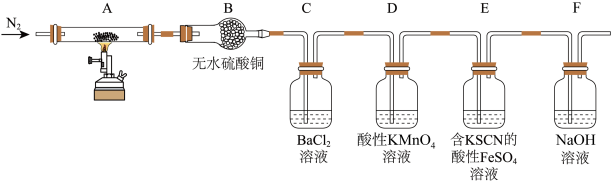
观察到的实验现象有:A中有固体残留;B中无水硫酸铜变蓝;C中产生白色沉淀;D中溶液颜色变浅、无沉淀产生;E中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为___________ 。
(2)C中产生的沉淀的化学式为___________ ,D中现象证明硫酸铜晶体的分解产物中含有___________ (填化学式)。
(3)E中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)为探究A中残留固体的成分(假设硫酸铜已完全分解),某同学查阅资料:铜有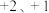 价,且分解产物中不含0价的铜。
价,且分解产物中不含0价的铜。 在酸性条件下不稳定,发生反应:
在酸性条件下不稳定,发生反应: 。验证A中固体产物中是否有
。验证A中固体产物中是否有 的实验方案为
的实验方案为___________ 。
Ⅱ.测定硫酸铜晶体中结晶水含量
实验步骤:
①称取 硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴盐酸酸化。
硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴盐酸酸化。
②向①所得溶液中滴加足量 溶液,得到白色沉淀,将所得沉淀过滤、洗涤、干燥,称得其质量为
溶液,得到白色沉淀,将所得沉淀过滤、洗涤、干燥,称得其质量为 。
。
(5)步骤②中检验沉淀是否洗涤干净的方法是:取少量最后一次洗涤液于试管中,滴加________ 溶液,若无沉淀生成则证明沉淀已洗涤干净。
(6)根据实验数据,硫酸铜晶体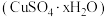 中x=
中x=_________ (用含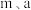 的代数式表示)。
的代数式表示)。
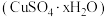 在不同温度下会逐步失去结晶水甚至分解。长郡化学社对硫酸铜晶体受热分解的产物成分进行探究,请回答下列问题:
在不同温度下会逐步失去结晶水甚至分解。长郡化学社对硫酸铜晶体受热分解的产物成分进行探究,请回答下列问题:I.探究硫酸铜晶体的分解产物
为探究硫酸铜晶体的分解产物,某同学设计了如下实验:

观察到的实验现象有:A中有固体残留;B中无水硫酸铜变蓝;C中产生白色沉淀;D中溶液颜色变浅、无沉淀产生;E中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为
(2)C中产生的沉淀的化学式为
(3)E中
 发生反应的离子方程式为
发生反应的离子方程式为(4)为探究A中残留固体的成分(假设硫酸铜已完全分解),某同学查阅资料:铜有
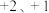 价,且分解产物中不含0价的铜。
价,且分解产物中不含0价的铜。 在酸性条件下不稳定,发生反应:
在酸性条件下不稳定,发生反应: 。验证A中固体产物中是否有
。验证A中固体产物中是否有 的实验方案为
的实验方案为Ⅱ.测定硫酸铜晶体中结晶水含量
实验步骤:
①称取
 硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴盐酸酸化。
硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴盐酸酸化。②向①所得溶液中滴加足量
 溶液,得到白色沉淀,将所得沉淀过滤、洗涤、干燥,称得其质量为
溶液,得到白色沉淀,将所得沉淀过滤、洗涤、干燥,称得其质量为 。
。(5)步骤②中检验沉淀是否洗涤干净的方法是:取少量最后一次洗涤液于试管中,滴加
(6)根据实验数据,硫酸铜晶体
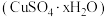 中x=
中x=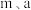 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



