砷(As)是一些工厂和矿山废水中的污染元素,其剧毒、难降解且易生物聚集的特点极大的威胁了水环境安全和人体健康。天然水体中砷元素主要以As(III)和As(V)存在,且As(III)的毒性更大。常见除砷的方法有沉淀法、氧化絮凝法和离子交换法等。
(1)沉淀法除砷:砷酸盐的溶解度小,工业上需要将废水中和至pH>12,再用氧化剂将As(III)转化成As(V),然后用石灰乳沉淀除砷,得到Ca5(AsO4)3OH沉淀。“沉砷”的最佳温度控制在80~85℃的原因是_______ 。
(2)高铁酸盐氧化絮凝法除砷。
已知:a.As(III)和As(V)水溶液中含砷的各物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图所示。
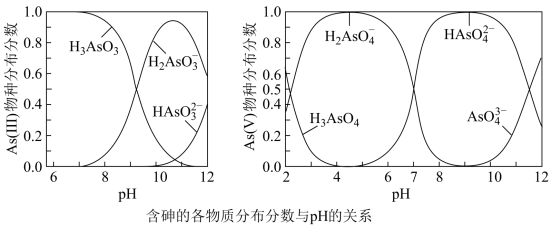
b.高铁酸钾易溶于水,具有强氧化性;溶液酸性越强,其氧化性越强;在pH<1的酸性条件下质子化,主要以HFeO 形式存在。
形式存在。
c.高铁酸钾在一定pH范围的水溶液中易生成Fe(OH)3胶体,溶液的pH对胶体粒子表面所带电荷有影响。pH=7.1时,胶体粒子表面不带电荷;pH>7.1时,胶体粒子表面带负电荷,pH越高,表面所带负电荷越多;pH<7.1时,胶体粒子表面带正电荷,pH越低,表面所带正电荷越多。
①pH<1时,HFeO 将As(III)氧化为As(V)的离子方程式为
将As(III)氧化为As(V)的离子方程式为_______ 。
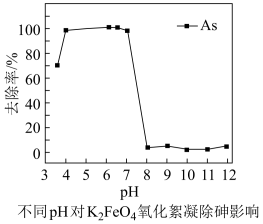
②在一定pH范围内,K2FeO4的还原产物可形成Fe(OH)3胶体,吸附As(V)的离子达到除砷目的;不同pH对K2FeO4氧化絮凝除砷影响如图所示。除砷过程中控制废水pH为4~7,pH过低或过高,砷的去除率都下降,其原因是_______ 。
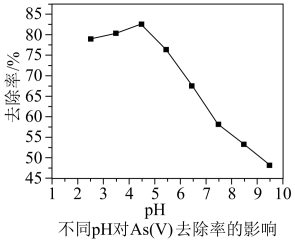
(3)离子交换法除砷:强碱性离子交换树脂上的OH与废水中的H2AsO 、HAsO
、HAsO 、AsO
、AsO 进行离子交换,OH-进入水中,H2AsO
进行离子交换,OH-进入水中,H2AsO 、HAsO
、HAsO 、AsO
、AsO 被树脂固定以达到除As(V)目的;不同pH对As(V)去除率的影响如图所示。结合As(V)在水溶液中的存在形态与pH的关系和OH-的交换效率分析,pH=4.5时去除率最高的原因是
被树脂固定以达到除As(V)目的;不同pH对As(V)去除率的影响如图所示。结合As(V)在水溶液中的存在形态与pH的关系和OH-的交换效率分析,pH=4.5时去除率最高的原因是_______ 。
(1)沉淀法除砷:砷酸盐的溶解度小,工业上需要将废水中和至pH>12,再用氧化剂将As(III)转化成As(V),然后用石灰乳沉淀除砷,得到Ca5(AsO4)3OH沉淀。“沉砷”的最佳温度控制在80~85℃的原因是
(2)高铁酸盐氧化絮凝法除砷。
已知:a.As(III)和As(V)水溶液中含砷的各物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图所示。

b.高铁酸钾易溶于水,具有强氧化性;溶液酸性越强,其氧化性越强;在pH<1的酸性条件下质子化,主要以HFeO
 形式存在。
形式存在。c.高铁酸钾在一定pH范围的水溶液中易生成Fe(OH)3胶体,溶液的pH对胶体粒子表面所带电荷有影响。pH=7.1时,胶体粒子表面不带电荷;pH>7.1时,胶体粒子表面带负电荷,pH越高,表面所带负电荷越多;pH<7.1时,胶体粒子表面带正电荷,pH越低,表面所带正电荷越多。
①pH<1时,HFeO
 将As(III)氧化为As(V)的离子方程式为
将As(III)氧化为As(V)的离子方程式为②在一定pH范围内,K2FeO4的还原产物可形成Fe(OH)3胶体,吸附As(V)的离子达到除砷目的;不同pH对K2FeO4氧化絮凝除砷影响如图所示。除砷过程中控制废水pH为4~7,pH过低或过高,砷的去除率都下降,其原因是

(3)离子交换法除砷:强碱性离子交换树脂上的OH与废水中的H2AsO
 、HAsO
、HAsO 、AsO
、AsO 进行离子交换,OH-进入水中,H2AsO
进行离子交换,OH-进入水中,H2AsO 、HAsO
、HAsO 、AsO
、AsO 被树脂固定以达到除As(V)目的;不同pH对As(V)去除率的影响如图所示。结合As(V)在水溶液中的存在形态与pH的关系和OH-的交换效率分析,pH=4.5时去除率最高的原因是
被树脂固定以达到除As(V)目的;不同pH对As(V)去除率的影响如图所示。结合As(V)在水溶液中的存在形态与pH的关系和OH-的交换效率分析,pH=4.5时去除率最高的原因是
更新时间:2021-11-12 19:02:32
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
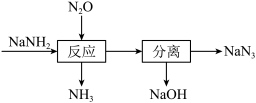
【推荐1】叠氮化钠(NaN3)可用于汽车安全气囊的产气药。一种由氨基化钠(NaNH2)制备NaN3的工艺流程如图。
①钠元素位于周期表第_____ 周期_____ 族。
②NaNH2中氮元素的化合价为_____ 。
③用单线桥 标出该反应电子转移的方向和数目_____ 。
(2)NaOH的电子式为_____ ,流程中“反应”的化学方程式为_____ 。
(3)NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积为_____ L。
①钠元素位于周期表第
②NaNH2中氮元素的化合价为
③用
(2)NaOH的电子式为
(3)NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
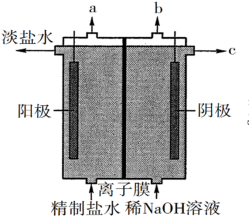
(1)氯气是制备系列含氯化合物的主要原料,可采用如图所示的装置来制取。装置中的离子膜只允许Na+离子通过,已知阳极发生氧化反应,则a口逸出的气体的分子式为_______ 。
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,请写出氯气与水反应生成HClO的离子方程式_______ 。
(3)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,5ClO +4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为
+4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为_______ mol;产生“气泡”的化学方程式为_______ 。
(4)“84消毒液”的有效成分为_______ ,不可与酸性清洁剂混用的原因是(用离子方程式表示)_______ 。
(5)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为_______ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图所示的装置来制取。装置中的离子膜只允许Na+离子通过,已知阳极发生氧化反应,则a口逸出的气体的分子式为

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,请写出氯气与水反应生成HClO的离子方程式
(3)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,5ClO
 +4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为
+4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为(4)“84消毒液”的有效成分为
(5)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择合适的完成指定转化。
试剂:C、CO2、Na2CO3溶液、K2SO4溶液、盐酸。
①K2O(一种碱性氧化物)→K2CO3的化学方程式:___________ ;
②Na3PO4→H3PO4的离子方程式:___________ ;
③浓硫酸→SO2的化学方程式:___________ 。
(2)以石灰渣[主要成分是Ca(OH)2]为原料生产氯酸钾的流程如下:
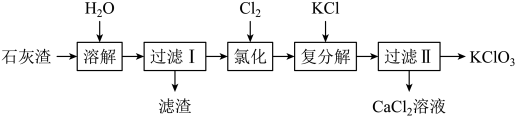
①氯化反应的温度为60℃,产物中的含氯化合物是CaCl2和Ca(ClO3)2,写出氯化反应的化学方程式:___________ ;
②写出复分解反应的化学方程式:___________ 。
(1)请从下列试剂中选择合适的完成指定转化。
试剂:C、CO2、Na2CO3溶液、K2SO4溶液、盐酸。
①K2O(一种碱性氧化物)→K2CO3的化学方程式:
②Na3PO4→H3PO4的离子方程式:
③浓硫酸→SO2的化学方程式:
(2)以石灰渣[主要成分是Ca(OH)2]为原料生产氯酸钾的流程如下:

①氯化反应的温度为60℃,产物中的含氯化合物是CaCl2和Ca(ClO3)2,写出氯化反应的化学方程式:
②写出复分解反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】习近平总书记十分重视生态环境保护,多次对生态文明建设作出重要指示。试回答下列与环境有关的问题:
(1)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:

该反应的正反应的ΔH_____ 0(填“>”或“<”)反应。
(2)汽车尾气是雾霾形成的原因之一、研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH<0
4N2(g)+6H2O(g) ΔH<0
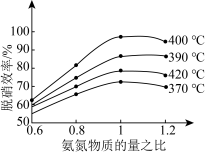
根据下图判断提高脱硝效率的最佳条件是_____ ;氨氮比一定时,在400℃时,脱硝效率最大,其可能的原因是_____ 。
(1)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:

该反应的正反应的ΔH
(2)汽车尾气是雾霾形成的原因之一、研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)
 4N2(g)+6H2O(g) ΔH<0
4N2(g)+6H2O(g) ΔH<0根据下图判断提高脱硝效率的最佳条件是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
(1)生成SO3____________ mol;
(2)O2的转化率为____________ ;
(3)平衡时体系中SO2的百分含量(体积分数)为____________ ;
(4)降低温度,O2的转化率____________ ;v正____________ ;(填“增大”、“减小”或“不变”)
(5)保持容器体积不变,加入He,则SO2的物质的量____________ 。(填“增大”、“减小”或“不变”)
(1)生成SO3
(2)O2的转化率为
(3)平衡时体系中SO2的百分含量(体积分数)为
(4)降低温度,O2的转化率
(5)保持容器体积不变,加入He,则SO2的物质的量
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】合理利用或转化NO2、NO、CO等污染性气体是人们共同关注的课题。
(1)实验证明汽车尾气中的NO与CO反应生成无污染气体而除去。
已知:i.N2(g)和O2(g)生成NO(g)过程中的能量变化如下:
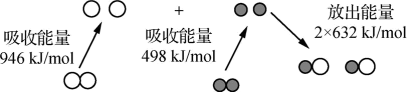
ii.NO2(g)+CO(g) CO2(g)+NO(g) ΔH=-234kJ·mol−1
CO2(g)+NO(g) ΔH=-234kJ·mol−1
iii.1mol NO(g)被O2(g)氧化时放出的热量为56.15kJ
①反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=_____ kJ·mol−1。
②工业上常用醋酸亚铜氨溶液来吸收CO,反应的化学方程式如下:CH3COOCu(NH3)2(aq)+CO(g) CH3COOCu(NH3)2·CO(aq) ΔH<0,吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有
CH3COOCu(NH3)2·CO(aq) ΔH<0,吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有_____ (选填序号)。
A.适当升高温度 B.适当降低温度 C.适当增大压强 D.适当减小压强
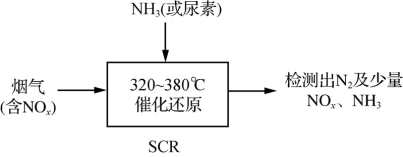
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,一般采用NH3或尿素[CO(NH2)2]作还原剂,基本流程如图所示:
①SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH<0,1mol O2能氧化NH3的物质的量是
4N2(g)+6H2O(g) ΔH<0,1mol O2能氧化NH3的物质的量是_____ 。若用CO(NH2)2作还原剂,还原NO2的化学方程式为___________ 。
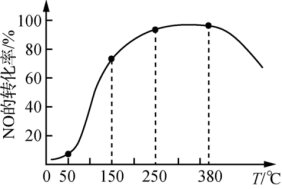
②其他条件不变,在相同时间内,NO转化为N2的转化率随温度的变化如图所示。反应温度在50℃~150℃范围内,NO转化为N2的转化率迅速上升,原因有___________ 。
(1)实验证明汽车尾气中的NO与CO反应生成无污染气体而除去。
已知:i.N2(g)和O2(g)生成NO(g)过程中的能量变化如下:

ii.NO2(g)+CO(g)
 CO2(g)+NO(g) ΔH=-234kJ·mol−1
CO2(g)+NO(g) ΔH=-234kJ·mol−1iii.1mol NO(g)被O2(g)氧化时放出的热量为56.15kJ
①反应2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=②工业上常用醋酸亚铜氨溶液来吸收CO,反应的化学方程式如下:CH3COOCu(NH3)2(aq)+CO(g)
 CH3COOCu(NH3)2·CO(aq) ΔH<0,吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有
CH3COOCu(NH3)2·CO(aq) ΔH<0,吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有A.适当升高温度 B.适当降低温度 C.适当增大压强 D.适当减小压强
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,一般采用NH3或尿素[CO(NH2)2]作还原剂,基本流程如图所示:

①SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH<0,1mol O2能氧化NH3的物质的量是
4N2(g)+6H2O(g) ΔH<0,1mol O2能氧化NH3的物质的量是②其他条件不变,在相同时间内,NO转化为N2的转化率随温度的变化如图所示。反应温度在50℃~150℃范围内,NO转化为N2的转化率迅速上升,原因有

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】沉淀溶解平衡
(1)概念
在一定温度下,当沉淀和溶解的速率_______________ 时,形成_______________ ,达到平衡状态,把这种平衡称为沉淀溶解平衡.
(2)沉淀溶解平衡的影响因素
(1)概念
在一定温度下,当沉淀和溶解的速率
(2)沉淀溶解平衡的影响因素
| 内因 | 难溶电解质 | |
| 外因 | 温度 | 升温,大多数溶解平衡向 |
| 浓度 | 加水稀释,平衡向 | |
| 相同离子 | 加入与难溶电解质含有相同离子的物质,平衡向 | |
| 反应离子 | 加入能消耗难溶电解质中所含离子的物质,平衡向 | |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。
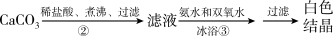
(1)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈______ 性(填“酸”“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是______ 。
(2)步骤③中反应的化学方程式为_____ ,该反应需要在冰浴下进行,原因是______ 。
(3)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_____ 。
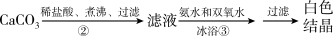
(1)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈
(2)步骤③中反应的化学方程式为
(3)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】依据信息书写下列反应的方程式
⑴K2O2可用于潜水设备中作供氧剂,写出K2O2与CO2反应的化学方程式:________ 。
⑵SO2是一种酸性氧化物,可制取Na2SO3,从括号内所给试剂(NaCl溶液、NaOH溶液、Na2SO4溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:________ 。
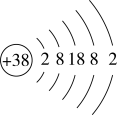
⑶锶(Sr)原子的结构示意图如图所示,锶能与水发生剧烈反应生成碱和氢气,写出单质锶与水反应的化学方程式:________ 。
⑷MnO2可经过下图所示的转化制取MnCO3。已知“反应Ⅱ”为复分解反应。
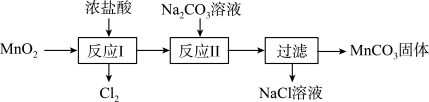
①写出“反应Ⅰ”的化学方程式:________ 。
②写出“反应Ⅱ”的离子方程式:________ 。
⑴K2O2可用于潜水设备中作供氧剂,写出K2O2与CO2反应的化学方程式:
⑵SO2是一种酸性氧化物,可制取Na2SO3,从括号内所给试剂(NaCl溶液、NaOH溶液、Na2SO4溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:
⑶锶(Sr)原子的结构示意图如图所示,锶能与水发生剧烈反应生成碱和氢气,写出单质锶与水反应的化学方程式:

⑷MnO2可经过下图所示的转化制取MnCO3。已知“反应Ⅱ”为复分解反应。

①写出“反应Ⅰ”的化学方程式:
②写出“反应Ⅱ”的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。
(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解,其化学反应式为:___________ 。
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是:________ ;通过质谱仪发现还有多种副反物,其中之一为: ,则该有机物核磁共振氢谱有
,则该有机物核磁共振氢谱有___ 个峰。
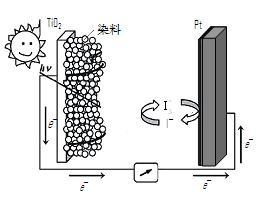
(3)利用半导材料TiO2与染料、铂电极及I 和I-的混合物作电解质(I2+I-
和I-的混合物作电解质(I2+I- I
I ),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为:
),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为:_______ 。
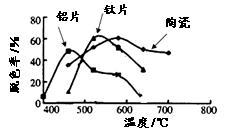
(4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考查不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如下。
 w ww.. co m
w ww.. co m
下列说法正确的是__________ 。
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO2薄膜的光催化活性不同

(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解,其化学反应式为:
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是:
 ,则该有机物核磁共振氢谱有
,则该有机物核磁共振氢谱有(3)利用半导材料TiO2与染料、铂电极及I
 和I-的混合物作电解质(I2+I-
和I-的混合物作电解质(I2+I- I
I ),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为:
),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为:(4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考查不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如下。
 w ww.. co m
w ww.. co m下列说法正确的是
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO2薄膜的光催化活性不同
您最近一年使用:0次



