高锰酸钾是一种强氧化剂,为紫黑色、细长的棱形结晶或颗粒,带蓝色的金属光泽,可溶于水。根据所学知识,回答下列问题:
(1)酸性条件下,高锰酸钾可与草酸( )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。
①补上产物,配平化学方程式___________ 。
②上述反应中 表现的性质有
表现的性质有___________ 。
(2)若将 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:___________ ,该反应中作还原剂的是___________ (填化学式)。
(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式___________ ,其中浓盐酸表现酸性与还原性的物质的量之比为:___________ 。
(1)酸性条件下,高锰酸钾可与草酸(
 )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。①补上产物,配平化学方程式
②上述反应中
 表现的性质有
表现的性质有(2)若将
 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式
21-22高三上·宁夏吴忠·阶段练习 查看更多[3]
宁夏吴忠中学2021-2022学年高三上学期第二次月考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
更新时间:2021-11-18 07:33:13
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图所示的装置来制取。装置中的离子膜只允许Na+离子通过,已知阳极发生氧化反应,则a口逸出的气体的分子式为_______ 。
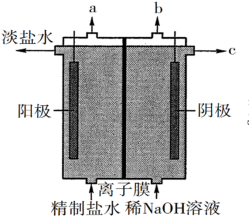
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,请写出氯气与水反应生成HClO的离子方程式_______ 。
(3)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,5ClO +4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为
+4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为_______ mol;产生“气泡”的化学方程式为_______ 。
(4)“84消毒液”的有效成分为_______ ,不可与酸性清洁剂混用的原因是(用离子方程式表示)_______ 。
(5)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为_______ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图所示的装置来制取。装置中的离子膜只允许Na+离子通过,已知阳极发生氧化反应,则a口逸出的气体的分子式为

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,请写出氯气与水反应生成HClO的离子方程式
(3)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,5ClO
 +4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为
+4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为(4)“84消毒液”的有效成分为
(5)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】物质的类别和核心元素的化合价是研究物质化学性质的两个重要角度。硫元素的价类二维图如图所示(其中h、g的阳离子均为 ),请回答下列问题:
),请回答下列问题:

(1)e的化学式是___________ 。
(2)实验室常用g和f的浓溶液制备气体c,写出其化学方程式___________ 。
(3)将气体c通入a的水溶液,溶液变浑浊,用化学方程式解释___________ ,体现了c的___________ 性。
(4)过量的铜与f的浓溶液在加热条件下可以发生,化学方程式为___________ ,反应后铜片有剩余,为使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如 溶液),则该反应的离子方程式为
溶液),则该反应的离子方程式为___________ 。
 ),请回答下列问题:
),请回答下列问题:
(1)e的化学式是
(2)实验室常用g和f的浓溶液制备气体c,写出其化学方程式
(3)将气体c通入a的水溶液,溶液变浑浊,用化学方程式解释
(4)过量的铜与f的浓溶液在加热条件下可以发生,化学方程式为
 溶液),则该反应的离子方程式为
溶液),则该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为: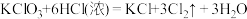 。
。
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)反应中,氧化剂为___________ ,氧化产物为:___________ 。
(3)浓盐酸在反应中体现出来的性质有___________ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为 ,该反应中还原剂是
,该反应中还原剂是___________ 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1个 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:
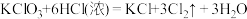 。
。(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)反应中,氧化剂为
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为
 ,该反应中还原剂是
,该反应中还原剂是(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个
 转移
转移
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】一氧化二氯(Cl2O)是次氯酸的酸酐,用作氯化剂,其部分性质如下:
实验室制备原理:2Na2CO3+H2O+2Cl2 2NaCl+2NaHCO3+Cl2O。
2NaCl+2NaHCO3+Cl2O。
现用下列装置设计实验制备少量Cl2O,并探究相关物质的性质。
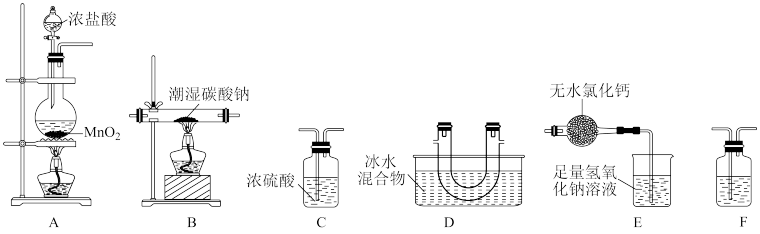
若气体从左至右流动,装置连接顺序是A、___________ (每个装置限用一次)。
| 物理性质 | 化学性质 |
| 常温下是棕黄色有刺激性气味的气体。 熔点:-120.6℃。沸点:2.0℃ | 不稳定,接触一般有机物易爆炸;易溶于水,同时反应生成次氯酸 |
 2NaCl+2NaHCO3+Cl2O。
2NaCl+2NaHCO3+Cl2O。现用下列装置设计实验制备少量Cl2O,并探究相关物质的性质。

若气体从左至右流动,装置连接顺序是A、
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某研究小组利用下图所示装置探究卤素的性质。___________ (填“氧化性”或“还原性”)。
(2)①中溶液有I2生成,发生反应的化学方程式是___________ 。
(3)②中NaOH溶液的作用是吸收多余的氯气,发生反应的离子方程式是___________ 。
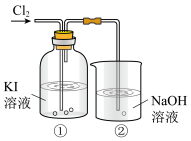
(2)①中溶液有I2生成,发生反应的化学方程式是
(3)②中NaOH溶液的作用是吸收多余的氯气,发生反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】图中为实验室制取氯气及性质验证的装置图:
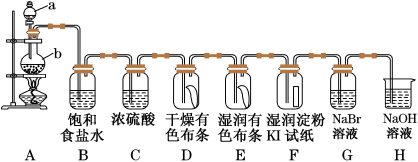
参考装置图回答下列问题:
(1)请指出仪器a的名称____________________ 写出装置A中反应的离子方程式____________
(2)在装置D中可观察到的现象是________ ,装置E中可观察到的现象是__________ 。
(3)装置B的作用为____________ ,装置C的作用为____________ ,装置H的作用为_____________ ,
(4)写出装置H中的离子方程式_____________ 。

参考装置图回答下列问题:
(1)请指出仪器a的名称
(2)在装置D中可观察到的现象是
(3)装置B的作用为
(4)写出装置H中的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】已知铜和浓硫酸可以在加热条件下发生反应(已配平): 。试通过计算和推理完成下面的问题
。试通过计算和推理完成下面的问题
(1)此反应中,硫酸体现了___________ 性和___________ 性。
(2)A物质可以导致酸雨的形成。A应该属于___________ 。(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(3)A可使紫红色的酸性KMnO4溶液褪色,此褪色反应中(填写化学式,下同)___________ 失去电子,氧化剂是___________ 。
 。试通过计算和推理完成下面的问题
。试通过计算和推理完成下面的问题(1)此反应中,硫酸体现了
(2)A物质可以导致酸雨的形成。A应该属于
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(3)A可使紫红色的酸性KMnO4溶液褪色,此褪色反应中(填写化学式,下同)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】下表是元素周期表的一部分,针对①~⑩元素在表中的位置,回答下列问题:
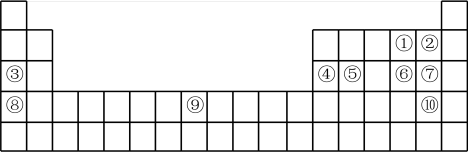
(1)⑨元素在元素周期表中的位置为___________ 。
(2)在①、②、③、④四种元素中,其离子半径按由大到小的顺序排列为___________ (用离子符号比较大小)。
(3)②、⑥、⑦元素所形成简单氢化物的稳定性由强到弱的顺序是___________ (用化学式比较强弱)。
(4)请写出⑥的最高价氧化物对应水化物和4的单质之间发生的化学方程式___________ 。
(5)写出⑩的单质与SO2水溶液反应的方程式:___________ 。
(6)写出工业制单质⑤的化学方程式___________ 。
(7)⑤的最高价氧化物与⑧的最高价氧化物对应的水化物反应的离子方程式___________ 。

(1)⑨元素在元素周期表中的位置为
(2)在①、②、③、④四种元素中,其离子半径按由大到小的顺序排列为
(3)②、⑥、⑦元素所形成简单氢化物的稳定性由强到弱的顺序是
(4)请写出⑥的最高价氧化物对应水化物和4的单质之间发生的化学方程式
(5)写出⑩的单质与SO2水溶液反应的方程式:
(6)写出工业制单质⑤的化学方程式
(7)⑤的最高价氧化物与⑧的最高价氧化物对应的水化物反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】二氧化硫易形成酸雨而污染大气,有效去除和利用 是环境保护的重要议题。
是环境保护的重要议题。
(1) 氧化法吸收
氧化法吸收 。向
。向 溶液中通入含有
溶液中通入含有 的烟气,反应温度为323K,反应一段时间。
的烟气,反应温度为323K,反应一段时间。
①上述反应的离子方程式为_______ 。
②随着吸收反应的进行,吸收剂溶液的pH逐渐_______ (填“增大”、“不变”或“减小”)。
(2) 利用。
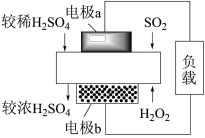
利用。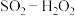 燃料电池的示意图如图。电极a为电池的
燃料电池的示意图如图。电极a为电池的_______ 极,电极b上发生的电极反应为_______ 。
(3)用含碘废水、 制取碘酸钾,其工艺流程如下:
制取碘酸钾,其工艺流程如下:

①检验含碘废水中是否含有 的常用试剂是
的常用试剂是_______ (写试剂名称)。
②通入 的目的是将
的目的是将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
③该工艺的五种物质的制备反应中,不涉及氧化还原反应的步骤是“制_______ ”。
 是环境保护的重要议题。
是环境保护的重要议题。(1)
 氧化法吸收
氧化法吸收 。向
。向 溶液中通入含有
溶液中通入含有 的烟气,反应温度为323K,反应一段时间。
的烟气,反应温度为323K,反应一段时间。①上述反应的离子方程式为
②随着吸收反应的进行,吸收剂溶液的pH逐渐
(2)
 利用。
利用。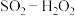 燃料电池的示意图如图。电极a为电池的
燃料电池的示意图如图。电极a为电池的
(3)用含碘废水、
 制取碘酸钾,其工艺流程如下:
制取碘酸钾,其工艺流程如下:
①检验含碘废水中是否含有
 的常用试剂是
的常用试剂是②通入
 的目的是将
的目的是将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为③该工艺的五种物质的制备反应中,不涉及氧化还原反应的步骤是“制
您最近一年使用:0次



