已知:硫代硫酸钠(化学式为Na2S2O3)易溶于水,具有强还原性,其相对分子质量是158。某实验室配制500mL0.100mol·L-1Na2S2O3溶液,并测定样品中CuSO4·5H2O的纯度:
(1)使用无水硫代硫酸钠进行配制,需要固体的质量是___________ 。配制过程中需要的玻璃仪器有玻璃棒、烧杯、胶头滴管和___________ 。
(2)配制时使用的蒸馏水需先烧开再冷却,其目的是___________ 。
(3)定容时俯视刻度线,则配制得到的Na2S2O3溶液的浓度将___________ (填“偏大”、“偏小”或“不变”)。定容时,如果不小心加水超过了刻度线,则处理的方法是___________ 。
(4)测定样品CuSO4·5H2O的纯度:准确称取0.5000gCuSO4·5H2O样品,加入适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.100mol·L-1Na2S2O3溶液反应至终点,消耗Na2S2O3溶液19.20mL。过程中发生下列反应:2CuSO4+4KI=2CuI↓+I2+2K2SO4;2Na2S2O3+I2=Na2S4O6+2NaI;计算CuSO4·5H2O样品的纯度(纯度=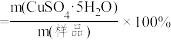 ,写出计算过程)
,写出计算过程)___________ 。
(1)使用无水硫代硫酸钠进行配制,需要固体的质量是
(2)配制时使用的蒸馏水需先烧开再冷却,其目的是
(3)定容时俯视刻度线,则配制得到的Na2S2O3溶液的浓度将
(4)测定样品CuSO4·5H2O的纯度:准确称取0.5000gCuSO4·5H2O样品,加入适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.100mol·L-1Na2S2O3溶液反应至终点,消耗Na2S2O3溶液19.20mL。过程中发生下列反应:2CuSO4+4KI=2CuI↓+I2+2K2SO4;2Na2S2O3+I2=Na2S4O6+2NaI;计算CuSO4·5H2O样品的纯度(纯度=
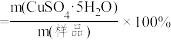 ,写出计算过程)
,写出计算过程)
更新时间:2021-11-17 10:20:17
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室欲配制6.0mol/L的H2SO4溶液,现有三种不同浓度的硫酸:
①480mL 0.5mol/L的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的浓硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.配制要求:①②两种硫酸全部用完,不足的部分由③来补充.
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为________ mol/L(保留1位小数).
(2)配制时的操作如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸________ mL,沿玻璃棒缓缓倒入上述混合液中,并不断搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入________ mL容量瓶中;
D._________________________________ ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1cm~2cm处,改用胶头滴管滴加,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(3)容量瓶使用前需________ ,瓶上标有________ 、________ 、________
(4)进行操作C前还需注意__________________ ,否则会使所配溶液的浓度_______ (填“偏大”、“偏小”或“无影响”).
①480mL 0.5mol/L的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的浓硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.配制要求:①②两种硫酸全部用完,不足的部分由③来补充.
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为
(2)配制时的操作如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸
C.将混合均匀的硫酸沿玻璃棒注入
D.
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1cm~2cm处,改用胶头滴管滴加,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(3)容量瓶使用前需
(4)进行操作C前还需注意
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取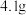 烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需
烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需_______ 。
(2)取 待测液,用
待测液,用_______ 量取。
(3)用 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视_______ ,直到看到_______ 即可判断达到滴定终点。
(4)根据表中数据,计算样品烧碱的质量分数为_______  结果保留四位有效数字
结果保留四位有效数字 。
。 假设烧碱中不含有与酸反应的杂质
假设烧碱中不含有与酸反应的杂质
(5)滴定过程,下列情况会使测定结果偏高的是_______ (填序号 。
。
①记录起始体积时,仰视读数,终点时俯视;
②碱式滴定管水洗后,就用来量取待测液;
③滴定前,酸式滴定管有气泡,滴定后消失;
④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;
⑤盐酸在滴定时溅出锥形瓶外;
Ⅱ.室温下,向20.00mL未知浓度的二元酸H2B中,逐滴加入0.1000 mol·L-1的NaOH溶液,用pH计测定溶液的pH,左侧纵轴表示混合溶液中各微粒的物质的量分数,相关数据如图所示(曲线③为滴定曲线)。
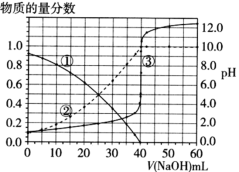
(1)H2B的一级电离方程式为_______ 。
(2)滴定终点时,溶液中c(Na+)=_______ 。
(3)B2-的水解常数_______ 。
(1)称取
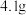 烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需
烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需(2)取
 待测液,用
待测液,用(3)用
 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视(4)根据表中数据,计算样品烧碱的质量分数为
 结果保留四位有效数字
结果保留四位有效数字 。
。 假设烧碱中不含有与酸反应的杂质
假设烧碱中不含有与酸反应的杂质
滴定次数 | 待测液体积 | 标准盐酸体积 | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
 。
。①记录起始体积时,仰视读数,终点时俯视;
②碱式滴定管水洗后,就用来量取待测液;
③滴定前,酸式滴定管有气泡,滴定后消失;
④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;
⑤盐酸在滴定时溅出锥形瓶外;
Ⅱ.室温下,向20.00mL未知浓度的二元酸H2B中,逐滴加入0.1000 mol·L-1的NaOH溶液,用pH计测定溶液的pH,左侧纵轴表示混合溶液中各微粒的物质的量分数,相关数据如图所示(曲线③为滴定曲线)。

(1)H2B的一级电离方程式为
(2)滴定终点时,溶液中c(Na+)=
(3)B2-的水解常数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某氯化铁样品含有FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
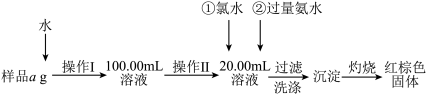
(1)操作I所用到的玻璃仪器除烧杯、量筒、100mL的容量瓶外,还必须有_________ (填仪器名称)。容量瓶使用前必须进行的操作是_________ (填序号)
A.干燥 B.验漏 C.润湿
(2)写出加入氯水发生反应的离子方程式_______________________________________ 。该反应若不用氯水,可用下列试剂中的______________ 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(3)检验沉淀已经洗涤干净的操作及现象是__________________________ 。
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是____________________ (列出原始算式,不需化简)

(1)操作I所用到的玻璃仪器除烧杯、量筒、100mL的容量瓶外,还必须有
A.干燥 B.验漏 C.润湿
(2)写出加入氯水发生反应的离子方程式
A.H2O2 B.碘水 C.NaClO
(3)检验沉淀已经洗涤干净的操作及现象是
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是__________________ (填写编号)。
(2)能够用以精确量取液体体积的是__________ (填写编号)。
(3)由于错误操作, 使得到的数据比正确数据偏小的是_____________ (填写编号)。
A.用量筒量取一定量液体时, 俯视液面读数。
B.中和滴定达终点时俯视滴定管内液面读数。
C.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中。
D.容量瓶刚用蒸馏水洗净,没有烘干。
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用。
G.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度。
(4) 称取10.5g固体样品(1g以下使用游码)时, 将样品放在了天平的右盘, 则所称样品的实际质量为________ g。
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是
(2)能够用以精确量取液体体积的是
(3)由于错误操作, 使得到的数据比正确数据偏小的是
A.用量筒量取一定量液体时, 俯视液面读数。
B.中和滴定达终点时俯视滴定管内液面读数。
C.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中。
D.容量瓶刚用蒸馏水洗净,没有烘干。
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用。
G.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度。
(4) 称取10.5g固体样品(1g以下使用游码)时, 将样品放在了天平的右盘, 则所称样品的实际质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管;⑧细口试剂瓶;⑨标签纸。
(1)现需要配制500 1
1 硫酸溶液,需用质量分数为98%、密度为1.84
硫酸溶液,需用质量分数为98%、密度为1.84 的浓硫酸
的浓硫酸__  。
。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______ 。
(3)容量瓶使用前检验漏水的方法是________ 。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?(填“偏高”“偏低”或“不变”)
①用以稀释硫酸的烧杯未洗涤,_________ 。
②未经冷却趁热将溶液注入容量瓶中,_______ 。
③摇匀后发现液面低于刻度线再加水,________ 。
④容量瓶中原有少量蒸馏水,________ 。
⑤定容时俯视观察液面,________ 。
(1)现需要配制500
 1
1 硫酸溶液,需用质量分数为98%、密度为1.84
硫酸溶液,需用质量分数为98%、密度为1.84 的浓硫酸
的浓硫酸 。
。(2)从上述仪器中,按实验使用的先后顺序,其编号排列是
(3)容量瓶使用前检验漏水的方法是
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?(填“偏高”“偏低”或“不变”)
①用以稀释硫酸的烧杯未洗涤,
②未经冷却趁热将溶液注入容量瓶中,
③摇匀后发现液面低于刻度线再加水,
④容量瓶中原有少量蒸馏水,
⑤定容时俯视观察液面,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:
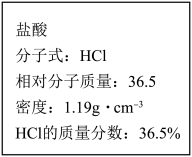
(1)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
(2)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为1.00 mol·L-1的稀盐酸,可供选用的仪器有:胶头滴管,玻璃棒,烧杯,药匙,量筒,托盘天平。请回答下列问题:
①配制稀盐酸时,还缺少的仪器有___________ (写仪器名称);该仪器上标有以下五项中的___________ ;
A.温度 B.浓度 C.容积 D.压强 E.刻度线
②该学生需要量取___________ mL上述浓盐酸进行配制(保留一位小数)。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”、“偏小”、“无影响”)。
a.定容时俯视观察刻度线___________ 。
b.量筒量取浓盐酸后再用蒸馏水洗涤2~3次,并将洗液移入容量瓶中___________ 。

(1)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
| A.溶液中HCl的物质的量 | B.溶液的物质的量浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
(2)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为1.00 mol·L-1的稀盐酸,可供选用的仪器有:胶头滴管,玻璃棒,烧杯,药匙,量筒,托盘天平。请回答下列问题:
①配制稀盐酸时,还缺少的仪器有
A.温度 B.浓度 C.容积 D.压强 E.刻度线
②该学生需要量取
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”、“偏小”、“无影响”)。
a.定容时俯视观察刻度线
b.量筒量取浓盐酸后再用蒸馏水洗涤2~3次,并将洗液移入容量瓶中
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验需要0.1mol/L NaOH溶液450mL,根据溶液配制中情况回答下列问题:
(1)实验中定容要用到________ mL的容量瓶。
(2)根据计算得知,所需NaOH的质量为________ g。
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________________ 。
A、用50mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确量取所需的NaOH的质量,倒入烧杯中加入适量水,用玻璃棒慢慢搅动
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、加水至离刻度线1~2cm处改用胶头滴管加水,使洛液凹面恰好与刻度相切
(4)对所配浓度影响的对应操作是(填写字母)偏大的有________ 。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(1)实验中定容要用到
(2)根据计算得知,所需NaOH的质量为
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A、用50mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确量取所需的NaOH的质量,倒入烧杯中加入适量水,用玻璃棒慢慢搅动
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、加水至离刻度线1~2cm处改用胶头滴管加水,使洛液凹面恰好与刻度相切
(4)对所配浓度影响的对应操作是(填写字母)偏大的有
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】氧化铁是重要的工业颜料,用废铁屑制备氧化铁的流程如图:
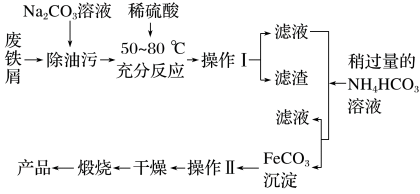
(1)操作Ⅰ的名称是___________ 。
(2)写出废铁屑与稀硫酸反应的离子方程式___________ 。
(3)加入NH4HCO3溶液时,在生成FeCO3沉淀的同时产生了使石灰水变浑浊的气体,写出该反应的离子方程式___________ 。
(4)有些同学认为用酸性KMnO4溶液滴定能进行铁元素含量的测定,其反应如下:5Fe2++MnO +8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验
+8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验
a.称取3.0g绿矾(FeSO4·7H2O)产品,溶解,配制成250 mL一定物质的量浓度的溶液;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.0100 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①配制100 ml 0.010 00 mol·L-1 KMnO4溶液时,下图不需要的仪器是___________ (写仪器名称)。除这些仪器外,还需要的仪器名称是___________ ;
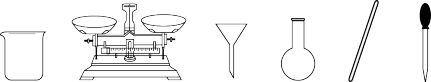
②)配制过程中,下列操作导致溶液浓度偏小的是___________ (填序号)。
A.加水定容时俯视刻度线
B.容量瓶未干燥处理
C.定容加水时超过刻度线后,立即吸出多余的水
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
③计算该样品中铁元素的质量分数___________ 。

(1)操作Ⅰ的名称是
(2)写出废铁屑与稀硫酸反应的离子方程式
(3)加入NH4HCO3溶液时,在生成FeCO3沉淀的同时产生了使石灰水变浑浊的气体,写出该反应的离子方程式
(4)有些同学认为用酸性KMnO4溶液滴定能进行铁元素含量的测定,其反应如下:5Fe2++MnO
 +8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验
+8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验a.称取3.0g绿矾(FeSO4·7H2O)产品,溶解,配制成250 mL一定物质的量浓度的溶液;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.0100 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①配制100 ml 0.010 00 mol·L-1 KMnO4溶液时,下图不需要的仪器是
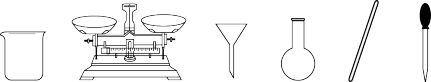
②)配制过程中,下列操作导致溶液浓度偏小的是
A.加水定容时俯视刻度线
B.容量瓶未干燥处理
C.定容加水时超过刻度线后,立即吸出多余的水
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
③计算该样品中铁元素的质量分数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室需要450mL 0.1mol·L-1NaOH溶液和500mL 0.5mol·L-1硫酸溶液。根据这两种溶液的配制情况回答下列问题:
(1)配制两种溶液所需的玻璃仪器除烧杯、量筒、胶头滴管、玻璃棒外还需使用______________ 。
(2)根据计算,用托盘天平称取NaOH的质量为______ g。在实验中其他操作均正确,若称量NaOH固体时砝码生锈,则所称量的质量_________ (填“偏大”“无影响”或“偏小”)。
(3)配制500mL 0.5mol·L-1硫酸溶液时需用到质量分数为98%、密度为1.84g·cm-3的浓硫酸,其物质的量浓度为:_____________ ;所需浓硫酸的体积为________ mL(计算结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用________ mL量筒最好。
(4)配制NaOH溶液时,正确的操作顺序是(用字母表示,每个字母只能用一次)_______ ;
A.用蒸馏水洗涤烧杯2~3次,将洗涤液转移至容量瓶,轻轻摇动容量瓶使溶液混合均匀
B.根据计算结果,用托盘天平称量所需NaOH固体;向小烧杯中加入少量蒸馏水,用玻璃棒慢慢搅拌,使其完全溶解
C.待溶液冷却后,将NaOH溶液沿玻璃棒注入容量瓶中
D.盖好瓶塞,上下颠倒,摇匀
E.继续往容量瓶中加入蒸馏水至液面离容量瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切
(5)下列操作会导致所配硫酸浓度偏高的是_____(填标号)。
(1)配制两种溶液所需的玻璃仪器除烧杯、量筒、胶头滴管、玻璃棒外还需使用
(2)根据计算,用托盘天平称取NaOH的质量为
(3)配制500mL 0.5mol·L-1硫酸溶液时需用到质量分数为98%、密度为1.84g·cm-3的浓硫酸,其物质的量浓度为:
(4)配制NaOH溶液时,正确的操作顺序是(用字母表示,每个字母只能用一次)
A.用蒸馏水洗涤烧杯2~3次,将洗涤液转移至容量瓶,轻轻摇动容量瓶使溶液混合均匀
B.根据计算结果,用托盘天平称量所需NaOH固体;向小烧杯中加入少量蒸馏水,用玻璃棒慢慢搅拌,使其完全溶解
C.待溶液冷却后,将NaOH溶液沿玻璃棒注入容量瓶中
D.盖好瓶塞,上下颠倒,摇匀
E.继续往容量瓶中加入蒸馏水至液面离容量瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切
(5)下列操作会导致所配硫酸浓度偏高的是_____(填标号)。
| A.稀释浓硫酸时,未冷却至室温即转入容量瓶进行定容 |
| B.用量筒量取浓硫酸时俯视刻度线 |
| C.定容时俯视容量瓶刻度线 |
| D.转移溶液时未洗涤烧杯 |
您最近一年使用:0次




