当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
则25℃时 和C(石墨,s)生成
和C(石墨,s)生成 的热化学方程式为
的热化学方程式为___________ 。
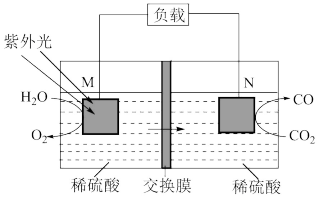
(2)某科研小组用电化学方法将 转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式
转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式___________ ,图中箭头所示为___________ 离子(填“ ”或“
”或“ ”)的迁移方向。当转化2mol
”)的迁移方向。当转化2mol 时,外电路转移电子的电量为
时,外电路转移电子的电量为___________ 。(已知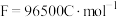 )
)
(3)我国科学家研究 电池,取得了重大科研成果,该电池中,
电池,取得了重大科研成果,该电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在___________ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.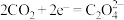 Ⅱ.
Ⅱ.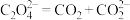
Ⅲ.___________ Ⅳ.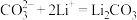
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
| 物质 |  (g) (g) | C(石墨,s) |  |
燃烧热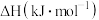 | −285.8 | −393.5 | −3267.5 |
则25℃时
 和C(石墨,s)生成
和C(石墨,s)生成 的热化学方程式为
的热化学方程式为(2)某科研小组用电化学方法将
 转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式
转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式 ”或“
”或“ ”)的迁移方向。当转化2mol
”)的迁移方向。当转化2mol 时,外电路转移电子的电量为
时,外电路转移电子的电量为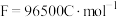 )
)
(3)我国科学家研究
 电池,取得了重大科研成果,该电池中,
电池,取得了重大科研成果,该电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。Ⅰ.
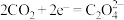 Ⅱ.
Ⅱ.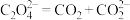
Ⅲ.
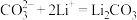
更新时间:2021-11-22 07:39:49
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出NaHCO3晶体,其反应的化学方程式是________ 。
②已知:ⅰ.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol− 1
ⅱ.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol− 1
反应2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g) ΔH=________ kJ·mol− 1。
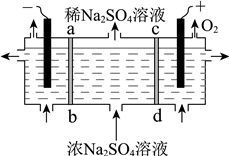
(2)制备烧碱和硫酸。
用右图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜。则阳极区制备的溶液是________ ,阴极的电极反应式是________ 。
(1)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出NaHCO3晶体,其反应的化学方程式是
②已知:ⅰ.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol− 1
ⅱ.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol− 1
反应2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g) ΔH=
(2)制备烧碱和硫酸。
用右图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜。则阳极区制备的溶液是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲烷和CO2是主要的温室气体,高效利用甲烷和CO2对缓解大气变暖有重要意义。
(1)图是利用太阳能将CO2分解制取炭黑的示意图:
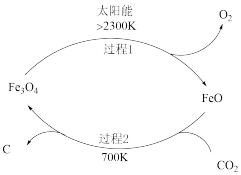
已知:①2Fe3O4(s)=6FeO(s)+O2(g) ΔH=a kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=b kJ·mol-1
则过程2的热化学方程式为_______
(2)在两个体积均为2 L的恒容密闭容器中,按表中相应的量加入物质,在相同温度下进行反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡转化率如表所示:
2CO(g)+2H2(g)的平衡转化率如表所示:
容器Ⅰ在10 min时反应达到平衡,该段时间内CH4的平均反应速率为_______ mol·L-1·min-1, 该温度下,容器Ⅰ的化学平衡常数KⅠ是_______ ;容器Ⅱ起始时反应向_______ (填“正反应方向”“逆反应方向”或“不移动”)进行。
(3)将一定量的甲烷和氧气混合发生反应2CH4(g)+O2(g) 2CO(g)+4H2(g),其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图所示。某同学判断c点一定没有达到平衡状态,他的理由是
2CO(g)+4H2(g),其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图所示。某同学判断c点一定没有达到平衡状态,他的理由是_______ 。

(4)CO2通过催化加氢可以合成乙醇,其反应原理为:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH<0,m=
C2H5OH(g)+3H2O(g) ΔH<0,m=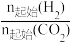 ,通过实验得到如图图像:
,通过实验得到如图图像:
①图1中m1、m2、m3最高的是_______ 。
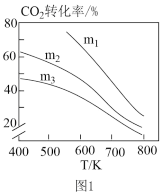
②图2表示在总压为p的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,列式表示该反应的压强平衡常数Kp_______ (写出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)图是利用太阳能将CO2分解制取炭黑的示意图:

已知:①2Fe3O4(s)=6FeO(s)+O2(g) ΔH=a kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=b kJ·mol-1
则过程2的热化学方程式为
(2)在两个体积均为2 L的恒容密闭容器中,按表中相应的量加入物质,在相同温度下进行反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡转化率如表所示:
2CO(g)+2H2(g)的平衡转化率如表所示:| 容器 | 起始物质的量(n)/mol | CO2的平衡 转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| Ⅰ | 0.2 | 0.2 | 0 | 0 | 50% |
| Ⅱ | 0.2 | 0.1 | 0.2 | 0.3 | / |
(3)将一定量的甲烷和氧气混合发生反应2CH4(g)+O2(g)
 2CO(g)+4H2(g),其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图所示。某同学判断c点一定没有达到平衡状态,他的理由是
2CO(g)+4H2(g),其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图所示。某同学判断c点一定没有达到平衡状态,他的理由是
(4)CO2通过催化加氢可以合成乙醇,其反应原理为:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) ΔH<0,m=
C2H5OH(g)+3H2O(g) ΔH<0,m=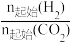 ,通过实验得到如图图像:
,通过实验得到如图图像:①图1中m1、m2、m3最高的是

②图2表示在总压为p的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,列式表示该反应的压强平衡常数Kp

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=___________ kJ·mol-1。
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
(3)CO和NO2也可反应,热化学方程式为2NO2(g)+4CO(g)⇌N2(g)+4CO2(g) ΔH4<0。T℃时,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如下:
①0~5min内,v正(CO2)=________ mol·L-1·min-1;该温度下反应的化学平衡常数K=________ (用分数表达)L·mol-1。
②其他条件不变,升高温度,NO2的平衡转化率___________ (填“增大”、“减小”或“不变”,下同),混合气体的密度___________ 。
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正___________ v逆(填“>”“<”或“=”)。
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
| A.CO和NO的物质的量之比不变 | B.该反应的化学平衡常数不变 |
| C.混合气体的压强保持不变 | D.v正(N2)=2v逆(CO) |
| 0min | 5min | 10min | 15min | 20min | |
| n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
| n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
②其他条件不变,升高温度,NO2的平衡转化率
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮及其化合物一直为环境科学领域研究的重点。
(1)废水中的NH3可通过硝化作用消除,已知:
NH3(g)+ O2(g)=NO
O2(g)=NO (aq)+H+(aq)+H2O(l) △H=-273.5kJ/mol
(aq)+H+(aq)+H2O(l) △H=-273.5kJ/mol
NO (aq)+
(aq)+ O2(g)=NO
O2(g)=NO (aq) △H=-73.19kJ/mol
(aq) △H=-73.19kJ/mol
则NH3通过硝化作用转化为NO 的热化学方程式为
的热化学方程式为_______ 。
(2)某科研小组设计双阴极微生物燃料电池进行同步硝化和反硝化脱氮研究,如图所示,“厌氧阳极”的电极反应方程式为_______ ,若“好氧阴极”1molNH 完全硝化生成NO
完全硝化生成NO ,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为
,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为_______ L。

(3)汽车尾气中的CO、NO等气体可在催化剂表面发生氧化还原反应进行消除,主要原理如下:2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H<0,某小组模拟该反应,在1L恒容密闭容器内将气体总物质的量为6mol的CO和NO以不同的物质的量比 进行反应。
进行反应。
①平衡时某反应物的转化率与物质的量比及温度的关系如图,纵坐标表示_______ 的转化率,T1和T2关系为T1_______ T2(填“>”“<”或“=”),图中A、B、C三点对应反应速率v(NO)正最大的是_______ 点。
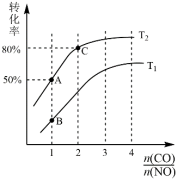
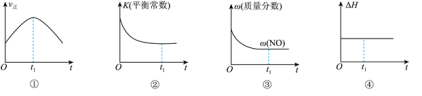
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______ 。
③已知:压强平衡常数Kp含义为:在平衡体系中用气体物质的分压(pi=p总×物质的量分数)代替浓度,计算得到的平衡常数。若容器内起始压强为p0,则C点的压强平衡常数_______ 。
(1)废水中的NH3可通过硝化作用消除,已知:
NH3(g)+
 O2(g)=NO
O2(g)=NO (aq)+H+(aq)+H2O(l) △H=-273.5kJ/mol
(aq)+H+(aq)+H2O(l) △H=-273.5kJ/molNO
 (aq)+
(aq)+ O2(g)=NO
O2(g)=NO (aq) △H=-73.19kJ/mol
(aq) △H=-73.19kJ/mol则NH3通过硝化作用转化为NO
 的热化学方程式为
的热化学方程式为(2)某科研小组设计双阴极微生物燃料电池进行同步硝化和反硝化脱氮研究,如图所示,“厌氧阳极”的电极反应方程式为
 完全硝化生成NO
完全硝化生成NO ,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为
,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为
(3)汽车尾气中的CO、NO等气体可在催化剂表面发生氧化还原反应进行消除,主要原理如下:2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H<0,某小组模拟该反应,在1L恒容密闭容器内将气体总物质的量为6mol的CO和NO以不同的物质的量比
 进行反应。
进行反应。①平衡时某反应物的转化率与物质的量比及温度的关系如图,纵坐标表示

②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是

③已知:压强平衡常数Kp含义为:在平衡体系中用气体物质的分压(pi=p总×物质的量分数)代替浓度,计算得到的平衡常数。若容器内起始压强为p0,则C点的压强平衡常数
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】短周期主族元素M、W、X、Y、Z的原子序数依次增大,M与W形成的一种化合物是生活中的常见的清洁能源,Y的原子半径是所有短周期主族元素中最大的,由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有淡黄色沉淀析出,同时有刺激性气体产生,回答下列问题:
(1)Y元素是____________ (元素名称),X在周期表的位置为:__________ 。
(2)Y2Z2的电子式:________________ 。
(3)X、Y、Z形成的盐与盐酸反应,有淡黄色沉淀析出,同时有刺激性气体产生的离子方程式:______________ 。
(4)Y2Z溶液的pH>7,其原因是(用离子方程式表示):__________________________ 。
(5)M2、WX的混合气体与空气构成碱性(KOH为电解质)燃料电池,若WX和M2体积比为1:2,W元素仅转化成MWX3-。负极总反应的电极反应式为________________ 。
(1)Y元素是
(2)Y2Z2的电子式:
(3)X、Y、Z形成的盐与盐酸反应,有淡黄色沉淀析出,同时有刺激性气体产生的离子方程式:
(4)Y2Z溶液的pH>7,其原因是(用离子方程式表示):
(5)M2、WX的混合气体与空气构成碱性(KOH为电解质)燃料电池,若WX和M2体积比为1:2,W元素仅转化成MWX3-。负极总反应的电极反应式为
您最近一年使用:0次
【推荐3】氮是化肥工业和化工生产的主要原料,工业上合成氨使用的氢气主要来自合成气(CO、H2混合气体)。请回答下列问题
(1)工业上合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH。
2NH3(g) ΔH。
①化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。
已知:
上述反应的ΔH=_______________________ 。
②在2 L恒容密闭容器中通入1 mol N2和3 mol H2,在一定条件下充分反应,达到平衡状态时,生成1.2 mol NH3,则该反应放出热量为______________ kJ。
(2)氮的催化氧化是工业上制备硝酸的重要反应,该化学反应方程式为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0。
4NO(g)+6H2O(g) ΔH<0。
①下列情况能说明该反应达到平衡状态的是__________ 。(填字母序号)
a.单位时间内断裂1 mol N-H键,同时生成1 mol O-H键
b.恒温恒容时,混合气体的压强保持不变
c.恒温恒容时,混合气体的密度保持不变
d.绝热容器中,温度保持不变
②若容器恒定不变,下列措施能提高反应速率的是__________ 。(填字母序号)
a.将水蒸气液化
b.降低温度
c.增大氨气的用量
d.使用高效催化剂
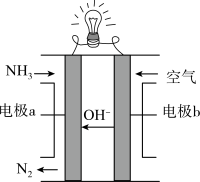
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。A电极反应式为______________________________________ 。若该燃料电池消耗标准状况下6.72 L空气(假设空气中O2体积分数为20%),则理论上消耗NH3的质量为_______ g。
(1)工业上合成氨的反应原理为N2(g)+3H2(g)
 2NH3(g) ΔH。
2NH3(g) ΔH。①化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。
已知:
| 化学键 | H-H | N≡N | N-H |
| 键能/kJ·mol-1 | 436 | 945.6 | 391 |
②在2 L恒容密闭容器中通入1 mol N2和3 mol H2,在一定条件下充分反应,达到平衡状态时,生成1.2 mol NH3,则该反应放出热量为
(2)氮的催化氧化是工业上制备硝酸的重要反应,该化学反应方程式为:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH<0。
4NO(g)+6H2O(g) ΔH<0。①下列情况能说明该反应达到平衡状态的是
a.单位时间内断裂1 mol N-H键,同时生成1 mol O-H键
b.恒温恒容时,混合气体的压强保持不变
c.恒温恒容时,混合气体的密度保持不变
d.绝热容器中,温度保持不变
②若容器恒定不变,下列措施能提高反应速率的是
a.将水蒸气液化
b.降低温度
c.增大氨气的用量
d.使用高效催化剂
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。A电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上用钒炉渣(主要含 FeO·V 2O3,还含有少量 SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V 2O3转化为可溶性的NaVO3,写出该反应的化学方程式____ ;浸出渣的主要成分为_______________ (填化学式)。
(2)用 MgSO4溶液除硅、磷时,滤渣的主要成分为 Mg3(PO4)2、MgSiO3。
①若滤液中 c(SiO32- )=0.08 mol·L-1,则 c(PO43- )=_____ 。(已知:Ksp (MgSiO3 )=2.4×10-5,Ksp [Mg3 (PO4 )2 ]=2.7×10-27)
②随着温度升高,Mg2+的水解程度增大,导致除磷率下降,但除硅率升高,其原因是____ 。[随温度升高,MgSiO3、Mg3(PO4)2的溶解度变化忽略不计]
(3)元素钒在溶液中主要以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(浅黄色)等形式存在。钒液可充电电池的工作原理如图所示。
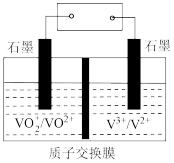
已知溶液中 c(H+)=1.0 mol·L-1,阴离子为 SO42-。
①充电时,左槽溶液颜色由蓝色逐渐变为浅黄色,则左侧电极的电极反应式为____ 。
②放电过程中,右槽溶液颜色变化为_____ 。
③放电时,若转移的电子数为 3.01×1022,则左槽溶液中 n(H+)的变化为_____ 。

(1)焙烧的目的是将FeO·V 2O3转化为可溶性的NaVO3,写出该反应的化学方程式
(2)用 MgSO4溶液除硅、磷时,滤渣的主要成分为 Mg3(PO4)2、MgSiO3。
①若滤液中 c(SiO32- )=0.08 mol·L-1,则 c(PO43- )=
②随着温度升高,Mg2+的水解程度增大,导致除磷率下降,但除硅率升高,其原因是
(3)元素钒在溶液中主要以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(浅黄色)等形式存在。钒液可充电电池的工作原理如图所示。

已知溶液中 c(H+)=1.0 mol·L-1,阴离子为 SO42-。
①充电时,左槽溶液颜色由蓝色逐渐变为浅黄色,则左侧电极的电极反应式为
②放电过程中,右槽溶液颜色变化为
③放电时,若转移的电子数为 3.01×1022,则左槽溶液中 n(H+)的变化为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组研究溶液中 与
与 、
、 的反应。
的反应。
资料: 在溶液中呈棕色。
在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用___________ 溶液检出溶液中含有 。
。
②甲认为是O2氧化了溶液中的 。乙认为O2不是主要原因,理由是
。乙认为O2不是主要原因,理由是___________ 。
③进行实验Ⅱ,装置如下图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式是___________ 。实验Ⅱ的目的是___________ 。
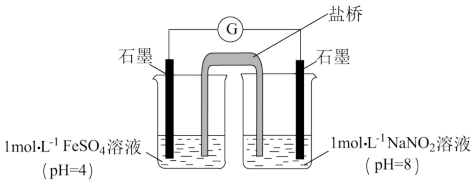
(2)研究现象a中的棕色溶液。
①综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的 或
或 发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。实验Ⅲ的操作和现象是
与NO发生了反应。实验Ⅲ的操作和现象是___________ 。
②加热实验I中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是___________ 。
(3)研究酸性条件下,溶液中 与
与 、
、 的反应。
的反应。
①i中溶液变为棕色的离子方程式是___________ 、___________ 。
②iii中出现棕色的原因是___________ 。
实验结论:本实验条件下,溶液中 、
、 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
 与
与 、
、 的反应。
的反应。| 实验Ⅰ | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 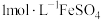 溶液(pH=4) 溶液(pH=4) |  溶液(pH=8) 溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
 溶液(加NaOH溶液至pH=8) 溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
 在溶液中呈棕色。
在溶液中呈棕色。(1)研究现象a中的黄色溶液。
①用
 。
。②甲认为是O2氧化了溶液中的
 。乙认为O2不是主要原因,理由是
。乙认为O2不是主要原因,理由是③进行实验Ⅱ,装置如下图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式是

(2)研究现象a中的棕色溶液。
①综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的
 或
或 发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。实验Ⅲ的操作和现象是
与NO发生了反应。实验Ⅲ的操作和现象是②加热实验I中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是
(3)研究酸性条件下,溶液中
 与
与 、
、 的反应。
的反应。| 序号 | 操作 | 现象 |
| i | 取 的NaNO2溶液,加醋酸至pH=3,加入 的NaNO2溶液,加醋酸至pH=3,加入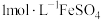 溶液 溶液 | 溶液立即变为棕色 |
| ii | 取 的NaNO3溶液,加醋酸至pH=3,加入 的NaNO3溶液,加醋酸至pH=3,加入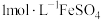 溶液 溶液 | 无明显变化 |
| iii | 分别取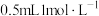 的NaNO3溶液与 的NaNO3溶液与 的FeSO4溶液,混合,小心加入0.5mL浓硫酸 的FeSO4溶液,混合,小心加入0.5mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
②iii中出现棕色的原因是
实验结论:本实验条件下,溶液中
 、
、 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】硅是太阳能电池的重要材料。方法1是目前工业冶炼纯硅的一种原理:
粗硅冶炼:
①
精炼硅:
②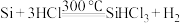
③
反应①过程中的能量变化如图所示,回答下列问题:
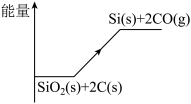
(1)①是________ 反应(填“吸热”或“放热”),结合图中信息说明判断依据__________ 。
(2)下列关于物质的性质与用途的说法均正确的是____________ 。(填字母)
A.石墨烯电阻率高,可用于制备动力电池
B.碳化硅硬度很大,用作砂纸和砂轮的磨料
C.硅单质是应用最广泛的半导体材料,其导电性介于导体和绝缘体之间
(3)工业上也曾用方法2来提纯单晶硅: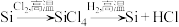 ,与方法1相比,方法2的缺点是
,与方法1相比,方法2的缺点是__________________________ 。
(4)某同学在用稀硫酸与锌制取氢气的实验中,意外地发现滴加几滴 溶液后反应速率加快了,原因可能是
溶液后反应速率加快了,原因可能是____________ 。(填字母)
a. 是催化剂 b.Zn、
是催化剂 b.Zn、 、
、 构成原电池
构成原电池
c.Zn、Cu、 构成原电池 d.上述分析均不正确
构成原电池 d.上述分析均不正确
粗硅冶炼:
①

精炼硅:
②
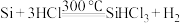
③

反应①过程中的能量变化如图所示,回答下列问题:

(1)①是
(2)下列关于物质的性质与用途的说法均正确的是
A.石墨烯电阻率高,可用于制备动力电池
B.碳化硅硬度很大,用作砂纸和砂轮的磨料
C.硅单质是应用最广泛的半导体材料,其导电性介于导体和绝缘体之间
(3)工业上也曾用方法2来提纯单晶硅:
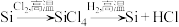 ,与方法1相比,方法2的缺点是
,与方法1相比,方法2的缺点是(4)某同学在用稀硫酸与锌制取氢气的实验中,意外地发现滴加几滴
 溶液后反应速率加快了,原因可能是
溶液后反应速率加快了,原因可能是a.
 是催化剂 b.Zn、
是催化剂 b.Zn、 、
、 构成原电池
构成原电池c.Zn、Cu、
 构成原电池 d.上述分析均不正确
构成原电池 d.上述分析均不正确
您最近一年使用:0次



