根据所学知识,回答下列问题:
(1)下列几种物质,其中属于电解质的是___________ ,属于弱电解质的是___________ (填序号)
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积___________ mL。
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。
①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式___________ 。
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为___________ 。
(1)下列几种物质,其中属于电解质的是
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO
 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为
21-22高一上·江苏苏州·期中 查看更多[1]
(已下线)【苏州新东方】苏州中学2021-2022学年高一上学期期中考试
更新时间:2021-12-01 18:42:03
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】溶液的浓度在生产生活中用途广泛,请填空
(1)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c( )=
)=______ 。
(2)某溶液中含有离子: 、
、 、
、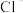 、
、 ,测得
,测得 、
、 和
和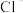 的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c(
的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c( )=
)=______ .
(3)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为___ 。
(4)VmLAl2(SO4)3溶液中含 ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中
ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中 的物质的量浓度是
的物质的量浓度是______ mol/L。
(1)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(
 )=
)=(2)某溶液中含有离子:
 、
、 、
、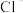 、
、 ,测得
,测得 、
、 和
和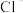 的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c(
的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c( )=
)=(3)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为
(4)VmLAl2(SO4)3溶液中含
 ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中
ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】分类法在化学中起着非常重要的作用,现有下列物质:① 、②
、② 溶液、③
溶液、③ 、④冰水混合物、⑤
、④冰水混合物、⑤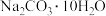 、⑥稀硫酸、⑦
、⑥稀硫酸、⑦ 、⑧镁铝合金。请回答下列问题:
、⑧镁铝合金。请回答下列问题:
(1)属于纯净物的有_______ ,属于氧化物的有_______ 。
(2)能导电的物质有_______ ,属于电解质的有_______ 。
(3)实验室中制取少量 胶体的化学方程式为
胶体的化学方程式为_______ 。
(4)已知 与
与 反应的化学方程式是
反应的化学方程式是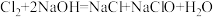 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_______ ,标准状况下,11.2L的Cl2含有原子数为_______ 。
(5)已知实验需要 硫酸,但实验室中只有物质的量浓度为
硫酸,但实验室中只有物质的量浓度为 的硫酸,该同学需要自己稀释,需要量取
的硫酸,该同学需要自己稀释,需要量取_______  的硫酸。
的硫酸。
 、②
、② 溶液、③
溶液、③ 、④冰水混合物、⑤
、④冰水混合物、⑤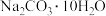 、⑥稀硫酸、⑦
、⑥稀硫酸、⑦ 、⑧镁铝合金。请回答下列问题:
、⑧镁铝合金。请回答下列问题:(1)属于纯净物的有
(2)能导电的物质有
(3)实验室中制取少量
 胶体的化学方程式为
胶体的化学方程式为(4)已知
 与
与 反应的化学方程式是
反应的化学方程式是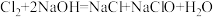 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(5)已知实验需要
 硫酸,但实验室中只有物质的量浓度为
硫酸,但实验室中只有物质的量浓度为 的硫酸,该同学需要自己稀释,需要量取
的硫酸,该同学需要自己稀释,需要量取 的硫酸。
的硫酸。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】化学计量在化学中占有重要地位。请回答下列问题:
(1)青蒿素C15H22O5的摩尔质量为____ 。
(2)在标准状况下,22.4L由O2和N2组成的混合气体中,含有的分子总数约为____ 。
(3)在标准状况下,含有3.01×1023个氦原子的氦气的体积约为____ 。
(4)某消毒小组人员用17mol·L-1的浓硫酸配制480mL3.4mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为____ mL;所配溶液中的H+的物质的量浓度为____ 。
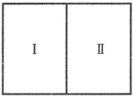
(5)如图所示,气缸的总体积一定,内部被活塞隔成I、II两部分,活塞可以自由移动,也可以固定。0℃时向I中充入8gSO2,II中充入8gO2,则当活塞不再移动时,I、II两部分体积比为____ 。
(1)青蒿素C15H22O5的摩尔质量为
(2)在标准状况下,22.4L由O2和N2组成的混合气体中,含有的分子总数约为
(3)在标准状况下,含有3.01×1023个氦原子的氦气的体积约为
(4)某消毒小组人员用17mol·L-1的浓硫酸配制480mL3.4mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
(5)如图所示,气缸的总体积一定,内部被活塞隔成I、II两部分,活塞可以自由移动,也可以固定。0℃时向I中充入8gSO2,II中充入8gO2,则当活塞不再移动时,I、II两部分体积比为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】有以下11种物质,请回答下列问题:①石墨 ②氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钡溶液 ⑧醋酸 ⑨盐酸 ⑩硫酸铝 ⑪稀硫酸。
(1)属于电解质的是____________________ ;属于非电解质的是___________ 。
(2)写出物质⑥溶于水的电离方程式:___________________________________ 。
(3)写出物质⑤和少量⑦反应的化学方程式:_______________________________________ 。
(4)写出物质⑥和⑧在水中发生反应的离子方程式:______________________________ 。
(1)属于电解质的是
(2)写出物质⑥溶于水的电离方程式:
(3)写出物质⑤和少量⑦反应的化学方程式:
(4)写出物质⑥和⑧在水中发生反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.现有下列10种物质:①铝,②氯气,③食盐水,④H2SO4,⑤Ba(OH)2固体,⑥熔融碳酸钠,⑦稀盐酸,⑧NaHCO3固体,⑨碳酸钙,⑩乙醇,⑪纯醋酸,⑫石墨棒
(1)其中属电解质的是___________ (填序号,下同),能导电的是___________
(2)①写出⑧在水溶液的电离方程式⑧___________ ;
②写出下列物质反应的离子方程式
⑨和⑦___________
④和⑤___________
Ⅱ.某溶液中可能含有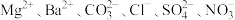 中的几种,现进行如下实验:
中的几种,现进行如下实验:
①取适量溶液,加入足量NaOH溶液,生成白色沉淀;
②过滤,向操作①所得滤液中加入足量H2SO4溶液,有白色沉淀生成。
根据上述实验回答下列问题。
(3)溶液中一定不存在的离子是___________ ;
(4)写出①中所发生反应的离子方程式:___________
(5)若同时存在 、
、 ,则溶液中阳离子总数与阴离子总数之比为
,则溶液中阳离子总数与阴离子总数之比为___________ 。
(1)其中属电解质的是
(2)①写出⑧在水溶液的电离方程式⑧
②写出下列物质反应的离子方程式
⑨和⑦
④和⑤
Ⅱ.某溶液中可能含有
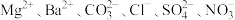 中的几种,现进行如下实验:
中的几种,现进行如下实验:①取适量溶液,加入足量NaOH溶液,生成白色沉淀;
②过滤,向操作①所得滤液中加入足量H2SO4溶液,有白色沉淀生成。
根据上述实验回答下列问题。
(3)溶液中一定不存在的离子是
(4)写出①中所发生反应的离子方程式:
(5)若同时存在
 、
、 ,则溶液中阳离子总数与阴离子总数之比为
,则溶液中阳离子总数与阴离子总数之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】现有下列10种物质:①Cu ②CO2 ③CaCO3 ④MgCl2溶液 ⑤乙醇 ⑥ 固体 ⑦Na2O ⑧氨水 ⑨熔融NaHSO4 ⑩液态HCl。
固体 ⑦Na2O ⑧氨水 ⑨熔融NaHSO4 ⑩液态HCl。
(1)上述10种物质中能导电的有___________ ,非电解质有___________ (填序号)。
(2)上述10种物质中有两种物质在水溶液中发生反应的离子方程式为 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(3)写出⑨的电离方程式:___________ 。
(4)写出稀盐酸与CaCO3反应的离子方程式:___________ 。
(5)写出MgCl2溶液与氨水的离子方程式:___________ 。
(6)向NaHSO4溶液中逐滴加入 溶液至
溶液至 完全沉淀,请写出发生反应的离子方程式:
完全沉淀,请写出发生反应的离子方程式:___________ 。
 固体 ⑦Na2O ⑧氨水 ⑨熔融NaHSO4 ⑩液态HCl。
固体 ⑦Na2O ⑧氨水 ⑨熔融NaHSO4 ⑩液态HCl。(1)上述10种物质中能导电的有
(2)上述10种物质中有两种物质在水溶液中发生反应的离子方程式为
 ,则该反应的化学方程式为
,则该反应的化学方程式为(3)写出⑨的电离方程式:
(4)写出稀盐酸与CaCO3反应的离子方程式:
(5)写出MgCl2溶液与氨水的离子方程式:
(6)向NaHSO4溶液中逐滴加入
 溶液至
溶液至 完全沉淀,请写出发生反应的离子方程式:
完全沉淀,请写出发生反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】无机化合物可根据其组成和性质进行分类,分类比较是研究物质性质常用的一类方法。
(1)下图所示的物质分类方法名称是___________ 。

(2)根据氧化物与酸碱反应的性质,可以对氧化物再分类:能与碱反应生成盐和水的氧化物是酸性氧化物,如CO2、SO3;能与酸反应生成盐和水的氧化物是碱性氧化物,如Na2O、CuO。下列有关说法正确的是___________ 。(填序号)
A.在化合物中,只要含有氧元素就属于氧化物
B.SO2既是非金属氧化物,又是酸性氧化物
C.不能与酸反应的氧化物一定能与碱反应
(3)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要分离提取 出砷元素,有同学建议用NaOH溶液,理由是___________ ,写出反应的化学方程式___________ 。
(4)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①___________ ;②2AsH3=2As+3H2
(1)下图所示的物质分类方法名称是

(2)根据氧化物与酸碱反应的性质,可以对氧化物再分类:能与碱反应生成盐和水的氧化物是酸性氧化物,如CO2、SO3;能与酸反应生成盐和水的氧化物是碱性氧化物,如Na2O、CuO。下列有关说法正确的是
A.在化合物中,只要含有氧元素就属于氧化物
B.SO2既是非金属氧化物,又是酸性氧化物
C.不能与酸反应的氧化物一定能与碱反应
(3)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要
(4)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】现有下列物质:①铜②硫酸溶液③CO2④NaHCO3固体⑤Ba(OH)2 固体⑥熔化的KNO3⑦漂粉精⑧红褐色的氢氧化铁胶体 ⑨氨水⑩稀硝酸
(1)⑦的主要成分的化学式是______ ,写出工业上制备⑦的化学方程式______ 。
(2)上述物质属于电解质的有_______ (填编号)。
(3)将④的溶液滴加到NaOH溶液中反应的离子方程式_______ 。
(4)工业废水中含有的重铬酸根离子( )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O) 做处理剂。将下面的离子方程式配平;
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O) 做处理剂。将下面的离子方程式配平;_______ 。口Fe2++口 + 口_______= 口Fe3++口Cr3++ 口。
+ 口_______= 口Fe3++口Cr3++ 口。
(1)⑦的主要成分的化学式是
(2)上述物质属于电解质的有
(3)将④的溶液滴加到NaOH溶液中反应的离子方程式
(4)工业废水中含有的重铬酸根离子(
 )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O) 做处理剂。将下面的离子方程式配平;
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O) 做处理剂。将下面的离子方程式配平; + 口_______= 口Fe3++口Cr3++ 口。
+ 口_______= 口Fe3++口Cr3++ 口。
您最近一年使用:0次
【推荐3】高铁酸钾是一种非氯高效消毒剂,主要用于饮用水处理。高铁酸钾(K2FeO4)在强碱性条件下能够稳定存在。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入饱和的KOH,使高铁酸钾析出。
(1)方法一:可利用固体反应物反应:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①生成物Na2FeO4中铁元素的化合价为________
②该反应中的还原剂是________ ,每生成1mol Na2FeO4转移_______ mol电子。
(2)方法二:
反应:Fe(OH)3+ClO-+OH-——FeO42-+Cl-+H2O(未配平)
①配平离子反应方程式:_____ Fe(OH)3+______ ClO-+_____ OH-=_____ FeO42-+______ Cl-+________ H2O
②若反应过程中转移了3mol电子,则还原产物的物质的量为_______ mol
(3)向Na2FeO4溶液中加入适量饱和的KOH溶液,有K2FeO4析出,请写出该反应的化学方程式________
(1)方法一:可利用固体反应物反应:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①生成物Na2FeO4中铁元素的化合价为
②该反应中的还原剂是
(2)方法二:
反应:Fe(OH)3+ClO-+OH-——FeO42-+Cl-+H2O(未配平)
①配平离子反应方程式:
②若反应过程中转移了3mol电子,则还原产物的物质的量为
(3)向Na2FeO4溶液中加入适量饱和的KOH溶液,有K2FeO4析出,请写出该反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】室温下,某水溶液中存在的离子有Na+、A-、H+、OH-。根据题意,回答下列问题:
(1)若 HA为强酸,由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________ 7。
(2)若溶液pH>7,则c(Na+)____ c(A-),理由是____ 。
(3)若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法中正确的是________(填选项代号)。
(1)若 HA为强酸,由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH
(2)若溶液pH>7,则c(Na+)
(3)若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法中正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知t℃时, 0.01 mol/L NaOH溶液的pH= 11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109请回答下列问题:
(1)该温度下,水的离子积Kw=_______ ,0.1mol/L的HA溶液中水电离出的c(OH-)=_______ 。
(2)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_______。
(3)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_______ m2(填“>”“<”或“=”)。
(4)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者_______ 后者(填“>”“<”或“=”)。
(1)该温度下,水的离子积Kw=
(2)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_______。
| A.水的电离程度 | B.c(HA)/c(A-) |
| C.溶液中c(H+)和c(OH- )的乘积 | D.溶液中c(OH- )的值 |

设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1
(4)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者
您最近一年使用:0次



