氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是___________ 。根据对角线规则,B的一些化学性质与元素___________ 的相似。
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是___________ 。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
2021高三·全国·专题练习 查看更多[1]
(已下线)考向36 原子结构与性质-备战2022年高考化学一轮复习考点微专题
更新时间:2021-12-09 07:07:50
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)Li与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_______ 。
(2)Li2O是离子晶体,其晶格能可通过如图的Borm-Haber循环计算得到。
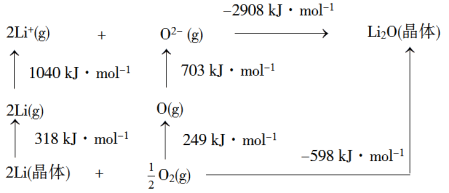
Li2O晶格能为_______ kJ·mol−1。
(1)Li与H-具有相同的电子构型,r(Li+)小于r(H-),原因是
(2)Li2O是离子晶体,其晶格能可通过如图的Borm-Haber循环计算得到。
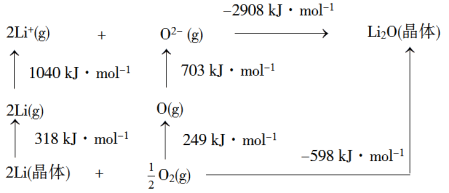
Li2O晶格能为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:_________ (填元素符号)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是:_________ ,碱性最强的化合物的电子式是:_________ 。
(3)元素⑤的单质与元素③的最高价氧化物对应的水化物反应的离子方程式为_________ 。
(4)元素②的简单氢化物是由_________ (填“极性”或“非极性”)键形成的,在常温下该化合物与元素⑥的单质反应的离子方程式为__________________ 。
(5)元素②、③、⑥、⑧四种元素形成的离子,离子半径由大到小的顺序是_________ (用离子符号表示)。
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
| 第二周期 | ① | ② | ||||||
| 第三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 第四周期 | ⑧ | ⑨ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是:
(3)元素⑤的单质与元素③的最高价氧化物对应的水化物反应的离子方程式为
(4)元素②的简单氢化物是由
(5)元素②、③、⑥、⑧四种元素形成的离子,离子半径由大到小的顺序是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】下表列出了 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:

(1)f的名称是_______ ,d的元素符号是_______ ;
(2)a在周期表中的位置是_______ ;
(3)h的原子结构示意图是_______ ;
(4)e、g、i按原子半径由大到小的顺序排列为_______ (填元素符号);
(5)c与h相比非金属性较强的是_______ (填元素符号),h的氢化物与i的氢化物相比,稳定性较弱的是_______ (填化学式);
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为_______ ;
(7)g的单质与氧化铁在高温条件下反应的化学方程式为_______ ;
(8)i的氢化物的电子式为_______ 。
 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:
(1)f的名称是
(2)a在周期表中的位置是
(3)h的原子结构示意图是
(4)e、g、i按原子半径由大到小的顺序排列为
(5)c与h相比非金属性较强的是
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为
(7)g的单质与氧化铁在高温条件下反应的化学方程式为
(8)i的氢化物的电子式为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】在周期表中,同一主族元素化学性质相似。目前也发现某些元素的性质和它在周期表中右下方的另一主族元素性质相似,这称为对角线规则。
据此请回答下列问题:
(1)锂在空气中燃烧,除生成__ 外,也生成微量的__ 。
(2)铍的最高价氧化物对应的水化物的化学式是__ ,属于两性化合物,证明这一结论的有关离子方程式为__ 。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3与足量强碱溶液反应的离子方程式为__ 。
(4)科学家证实,BeCl2属于共价化合物,设计一个简单实验证明,其方法是__ 。用电子式表示BeCl2的形成过程:__ 。
据此请回答下列问题:
(1)锂在空气中燃烧,除生成
(2)铍的最高价氧化物对应的水化物的化学式是
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3与足量强碱溶液反应的离子方程式为
(4)科学家证实,BeCl2属于共价化合物,设计一个简单实验证明,其方法是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】按要求填空。
(1) 中心原子价层电子对互斥模型为
中心原子价层电子对互斥模型为_______ 。
(2)等电子体是具有相同的价电子数和原子数的分子或离子,它们通常具有相似的空间结构。CO的结构式为_______ , 的空间结构为
的空间结构为_______ 。
(3)根据对角线规则,铍(Be)的性质_______ (填化学式)相似,能与氢氧化钠溶液反应。写出氢氧化铍与氢氧化钠溶液反应的化学方程式_______ 。
(4)某有机物结构简式为 ,该分子中含有
,该分子中含有_______ 个手性碳原子。
(1)
 中心原子价层电子对互斥模型为
中心原子价层电子对互斥模型为(2)等电子体是具有相同的价电子数和原子数的分子或离子,它们通常具有相似的空间结构。CO的结构式为
 的空间结构为
的空间结构为(3)根据对角线规则,铍(Be)的性质
(4)某有机物结构简式为
 ,该分子中含有
,该分子中含有
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】二氧化钛、四氯化钛、钛酸钡等钛及其化合物在人们的生活中起着十分重要的作用,应用极广。回答下列问题:
(1)基态钛原子的价电子排布式为_______ ,基态 中的核外电子有
中的核外电子有_______ 个空间运动状态。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
① 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是_______ ,B原子的杂化轨道类型是_______ , 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为_______ 。
②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是_______ 填元素符号。
(1)基态钛原子的价电子排布式为
 中的核外电子有
中的核外电子有(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①
 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是
| 元素 | M |
| 电离能(kJ/mol) | 738 |
| 1451 | |
| 7733 | |
| 10540 | |
| 13630 |
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】H2SeO4比H2SeO3酸性强的原因:___ 。
您最近一年使用:0次

 的资源化利用是解决温室效应的重要途径。科学家致力于
的资源化利用是解决温室效应的重要途径。科学家致力于 反应制
反应制 的研究。
的研究。 ,
, 。
。 键与
键与 键个数之比为
键个数之比为

