实验室有一瓶未知浓度的稀盐酸,某兴趣小组通过滴定法测定其浓度,具体操作如下:
用0.10 mol/L KOH溶液滴定盐酸的浓度,操作可分解为如下几步:
A.移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞作指示剂
B.用标准溶液润洗碱式滴定管2~3次
C.排气泡,使碱式滴定管尖嘴充满溶液
D.取KOH标准溶液注入碱式滴定管至0刻度以上2~3 cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下方,用KOH标准溶液滴定至终点,
记下滴定管液面的读数
(1)正确操作的顺序是B→_______→_______→E→_______→______________
a.D C A F b. D C F A c.C D A F
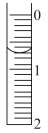
(2)步骤E调节液面后位置如图所示,则此时的读数为_______ mL。
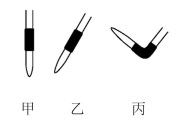
(3)排除碱式滴定管中气泡的方法应采用如图所示操作中的_______ ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
(5)选用酚酞作指示剂,如何判断滴定终点_______ 。
用0.10 mol/L KOH溶液滴定盐酸的浓度,操作可分解为如下几步:
A.移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞作指示剂
B.用标准溶液润洗碱式滴定管2~3次
C.排气泡,使碱式滴定管尖嘴充满溶液
D.取KOH标准溶液注入碱式滴定管至0刻度以上2~3 cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下方,用KOH标准溶液滴定至终点,
记下滴定管液面的读数
(1)正确操作的顺序是B→_______→_______→E→_______→_______
a.D C A F b. D C F A c.C D A F
(2)步骤E调节液面后位置如图所示,则此时的读数为

(3)排除碱式滴定管中气泡的方法应采用如图所示操作中的

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
| A.滴定终点读数时俯视读数 |
| B.酸式滴定管使用前,水洗后未用待测盐酸润洗 |
| C.碱式滴定管尖嘴部分有气泡,滴定后消失 |
| D.锥形瓶水洗后未干燥 |
更新时间:2021-11-08 20:04:29
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】一氯胺(NH2Cl)是重要的水消毒剂,某兴趣小组实验室模拟制备一氯胺并测定其含量实验如下:
实验一:制备NaClO溶液(实验装置图所示)

连接好装置,检查气密性后,加入药品,打开K1关闭K2,将装置I产生的气体通入装置II中制备NaClO溶液。
实验二:制备NH2Cl一段时间后,关闭K1打开K2,将装置III产生的气体也通入装置II中制备得到一氯胺(NH2Cl)。
实验三:测定一氯胺(NH2Cl)含量用移液管移取20.00mL实验后装置II中溶液,加入过量的碘化钾溶液,充分反应后,用0.100mol/L的Na2S2O3溶液进行滴定。
请回答:
(1)实验一中用冰水浴控制温度的主要目的___ 。
(2)请写出实验二制备NH2Cl的化学方程式___ 。
(3)关于一氯胺(NH2Cl)制备过程中下列说法正确的是___ 。
(4)在实验三滴定过程中使用到碱式滴定管(部分如图所示),选出其正确操作并按顺序列出字母:蒸馏水洗涤→加入待装液3~5mL→____→____→____→____→____→滴定___ 。

a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm
e.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
f.橡皮管向上弯曲,挤压玻璃球a处,放液
g.橡皮管向上弯曲,挤压玻璃球b处,放液
h.橡皮管向上弯曲,挤压玻璃球c处,放液
达到终点时,消耗Na2S2O3溶液如表:
已知:NH2Cl+I-+H2O→NH3•H2O+OH-+Cl-+I ,I
,I
 I2+I-,I2+S2O
I2+I-,I2+S2O →I-+S4O
→I-+S4O (未配平)。
(未配平)。
(5)判定达到滴定终点的现象是___ 。
(6)该溶液中一氯胺的物质的量浓度为___ 。
实验一:制备NaClO溶液(实验装置图所示)

连接好装置,检查气密性后,加入药品,打开K1关闭K2,将装置I产生的气体通入装置II中制备NaClO溶液。
实验二:制备NH2Cl一段时间后,关闭K1打开K2,将装置III产生的气体也通入装置II中制备得到一氯胺(NH2Cl)。
实验三:测定一氯胺(NH2Cl)含量用移液管移取20.00mL实验后装置II中溶液,加入过量的碘化钾溶液,充分反应后,用0.100mol/L的Na2S2O3溶液进行滴定。
请回答:
(1)实验一中用冰水浴控制温度的主要目的
(2)请写出实验二制备NH2Cl的化学方程式
(3)关于一氯胺(NH2Cl)制备过程中下列说法正确的是
| A.实验一装置I中KMnO4可用MnO2代替 |
| B.装置II中尾气处理管可以起防倒吸作用 |
| C.实验二需控制NH3的用量,防止生成多氯胺等杂质 |
| D.已知:NH2Cl在中性环境中易发生水解,其化学方程式为:NH2Cl+H2O=HCl+NH2OH |

a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm
e.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
f.橡皮管向上弯曲,挤压玻璃球a处,放液
g.橡皮管向上弯曲,挤压玻璃球b处,放液
h.橡皮管向上弯曲,挤压玻璃球c处,放液
达到终点时,消耗Na2S2O3溶液如表:
| 实验 | 消耗Na2S2O3溶液体积(mL) |
| 第一次 | 4.98 |
| 第二次 | 4.73 |
| 第三次 | 5.02 |
 ,I
,I
 I2+I-,I2+S2O
I2+I-,I2+S2O →I-+S4O
→I-+S4O (未配平)。
(未配平)。(5)判定达到滴定终点的现象是
(6)该溶液中一氯胺的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4溶液25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入几滴酚酞做指示剂
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管,调整液面,记下开始读数
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
滴定操作的正确顺序是(用序号填写)_______________ 。
(2)在D操作中应该调整液面到_________________ ,并使尖嘴处_____________ 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是__________________ 。
(4)滴定到终点时锥形瓶内溶液的pH约为________ ;终点时颜色变化是____________ 。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____ (选填“甲”或“乙”)中。

(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)____ 。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4溶液25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入几滴酚酞做指示剂
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管,调整液面,记下开始读数
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
滴定操作的正确顺序是(用序号填写)
(2)在D操作中应该调整液面到
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(4)滴定到终点时锥形瓶内溶液的pH约为
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入

(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛___________ 。
(2)滴定终点的判断:___________ 。
(3)某学生根据3次实验分别记录有关数据如表:
根据表中数据该NaOH溶液的物质的量浓度为___________ 。
(4)以下操作会导致测得的NaOH溶液浓度偏高的是___________。
(5)氧化还原滴定实验的原理与中和滴定相同,即用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。为测定某样品中所含晶体 的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用
的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用 溶液滴定(杂质与
溶液滴定(杂质与 不反应)。若消耗
不反应)。若消耗
 溶液20.00mL,所得晶体中
溶液20.00mL,所得晶体中 的质量分数为
的质量分数为___________ (用a表示, 的摩尔质量为
的摩尔质量为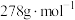 )。
)。
(1)用标准盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛
(2)滴定终点的判断:
(3)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 4.21 | 30.31 |
| 第三次 | 25.00 | 0.22 | 26.31 |
(4)以下操作会导致测得的NaOH溶液浓度偏高的是___________。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(5)氧化还原滴定实验的原理与中和滴定相同,即用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。为测定某样品中所含晶体
 的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用
的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用 溶液滴定(杂质与
溶液滴定(杂质与 不反应)。若消耗
不反应)。若消耗
 溶液20.00mL,所得晶体中
溶液20.00mL,所得晶体中 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为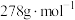 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】已知某NaOH试样中含有NaCl杂质,为测定试样中 NaOH 的质量分数,进行如下步骤实验:
①称量 1.0g 样品溶于水,配成 250 mL 溶液;
②准确量取 25.00 mL 所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用 0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
请回答:
(1)将样品配成 250 mL 溶液,除小烧杯、玻璃棒外,还需用到的玻璃仪器有_______ 、_______ 。
(2)用_______ 滴定管(填“酸式”或“碱式”)盛装 0.10mol/L 盐酸标准液。
(3)滴定到终点的标志是_______ 。
(4)若出现下列情况,测定结果偏高的是_______ 。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
(5)烧碱样品的纯度为_______ 。
①称量 1.0g 样品溶于水,配成 250 mL 溶液;
②准确量取 25.00 mL 所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用 0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)将样品配成 250 mL 溶液,除小烧杯、玻璃棒外,还需用到的玻璃仪器有
(2)用
(3)滴定到终点的标志是
(4)若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
(5)烧碱样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某实验活动小组在实验室进行中和反应反应热的测定。请回答下列问题:
(1)测定中和反应反应热的实验装置如图所示。在两个烧杯之间填弃碎泡沫塑料的目的是______ 。

(2)在进行中和反应反应热的测定中,量取50 mL 0.50mol/L的盐酸,倒入小烧杯中,测量盐酸的温度,然后需加入下列______ 试剂(填序号)
①50mL 0.50mol/L NaOH溶液
②50mL 0.55mol/L NaOH溶液
③1.0g NaOH固体
(3)下述情况会使中和反应反应热的测定结果偏小的是(填序号)______
a.用量筒量取50mL 0.50mol/L的盐酸时仰视读数
b.分多次把(2)中所选试剂倒入盛有盐酸的小烧杯中
c.用醋酸代替盐酸
(1)测定中和反应反应热的实验装置如图所示。在两个烧杯之间填弃碎泡沫塑料的目的是

(2)在进行中和反应反应热的测定中,量取50 mL 0.50mol/L的盐酸,倒入小烧杯中,测量盐酸的温度,然后需加入下列
①50mL 0.50mol/L NaOH溶液
②50mL 0.55mol/L NaOH溶液
③1.0g NaOH固体
(3)下述情况会使中和反应反应热的测定结果偏小的是(填序号)
a.用量筒量取50mL 0.50mol/L的盐酸时仰视读数
b.分多次把(2)中所选试剂倒入盛有盐酸的小烧杯中
c.用醋酸代替盐酸
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】以软锰矿(主要成分为 )为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取
)为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取 样品,加水溶解后定容于
样品,加水溶解后定容于 容量瓶中,摇匀。取物质的量浓度为
容量瓶中,摇匀。取物质的量浓度为 的
的 标准溶液
标准溶液 ,加入稀硫酸酸化,用上述配制的
,加入稀硫酸酸化,用上述配制的 溶液平行滴定三次,平均消耗
溶液平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知: 。回答下列问题:
。回答下列问题:
(1)为准确量取 的
的 标准溶液,最好选用的仪器为
标准溶液,最好选用的仪器为_______ (填标号)。


(2)已知 的结构式如图所示:
的结构式如图所示: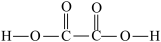 。
。
①0.1mol 分子中含有的σ键的数目为
分子中含有的σ键的数目为_______ 。
② 分子中有
分子中有_______ 种非极性键。
③有机物大多难溶于水,而 可与水互溶的原因为
可与水互溶的原因为_______
(3)基态M原子有5个未成对电子,则在前四周期中,基态原子未成对电子数最多的元素是_______ (元素填符号),基态原子有3个未成对电子的元素有_______ 种。
(4)该样品纯度的计算式为_______ (用含a、c、 、
、 、
、 的代数式表示)。
的代数式表示)。
 )为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取
)为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取 样品,加水溶解后定容于
样品,加水溶解后定容于 容量瓶中,摇匀。取物质的量浓度为
容量瓶中,摇匀。取物质的量浓度为 的
的 标准溶液
标准溶液 ,加入稀硫酸酸化,用上述配制的
,加入稀硫酸酸化,用上述配制的 溶液平行滴定三次,平均消耗
溶液平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知: 。回答下列问题:
。回答下列问题:(1)为准确量取
 的
的 标准溶液,最好选用的仪器为
标准溶液,最好选用的仪器为


(2)已知
 的结构式如图所示:
的结构式如图所示: 。
。①0.1mol
 分子中含有的σ键的数目为
分子中含有的σ键的数目为②
 分子中有
分子中有③有机物大多难溶于水,而
 可与水互溶的原因为
可与水互溶的原因为(3)基态M原子有5个未成对电子,则在前四周期中,基态原子未成对电子数最多的元素是
(4)该样品纯度的计算式为
 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】食醋是烹饪美食的调味品,有效成分主要为醋酸(用 表示)。
表示)。 的应用与其电离平衡密切相关。25℃时,
的应用与其电离平衡密切相关。25℃时, 的
的 。
。
(1)配制 的
的 溶液,需
溶液,需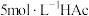 溶液的体积为
溶液的体积为___________ mL。
(2)下列关于 容量瓶的操作,正确的是
容量瓶的操作,正确的是___________ 。
(3)某小组研究25℃下 电离平衡的影响因素。
电离平衡的影响因素。
提出假设:稀释 溶液或改变
溶液或改变 浓度,
浓度, 电离平衡会发生移动。设计方案并完成实验。用浓度均为
电离平衡会发生移动。设计方案并完成实验。用浓度均为 的
的 和
和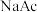 溶液,按下表配制总体积相同的系列溶液;测定
溶液,按下表配制总体积相同的系列溶液;测定 ,记录数据。
,记录数据。
①根据表中信息,补充数据:
___________ ,
___________ 。
②由实验I和Ⅱ可知,稀释 溶液,电离平衡
溶液,电离平衡___________ (填”正”或”逆”,下同)向移动;
③由实验Ⅱ~Ⅷ可知,增大 浓度,
浓度, 电离平衡
电离平衡 ___________ 向移动。
实验结论:假设成立。
(4)移取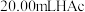 溶液,加入2滴指示剂溶液,用
溶液,加入2滴指示剂溶液,用 溶液滴定至终点,消耗体积为
溶液滴定至终点,消耗体积为 ,则该
,则该 溶液的浓度为0.1104
溶液的浓度为0.1104 。
。
①该中和滴定实验应选择___________ 指示剂;滴定终点的现象是___________ 。
②在答题卡坐标纸 中,画出上述过程的滴定曲线示意图并标注滴定终点。___________
(5)下列操作会导致测定结果偏低的是___________ (填字母)。
a.锥形瓶用待测液润洗
b.装氢氧化钠溶液的滴定管没有润洗
c.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
d.滴定前平视,滴定结束时俯视读数
 表示)。
表示)。 的应用与其电离平衡密切相关。25℃时,
的应用与其电离平衡密切相关。25℃时, 的
的 。
。(1)配制
 的
的 溶液,需
溶液,需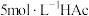 溶液的体积为
溶液的体积为(2)下列关于
 容量瓶的操作,正确的是
容量瓶的操作,正确的是
(3)某小组研究25℃下
 电离平衡的影响因素。
电离平衡的影响因素。提出假设:稀释
 溶液或改变
溶液或改变 浓度,
浓度, 电离平衡会发生移动。设计方案并完成实验。用浓度均为
电离平衡会发生移动。设计方案并完成实验。用浓度均为 的
的 和
和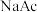 溶液,按下表配制总体积相同的系列溶液;测定
溶液,按下表配制总体积相同的系列溶液;测定 ,记录数据。
,记录数据。| 序号 | 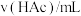 | 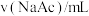 |  |  |  |
| I | 40.00 | / | / | 0 | 2.86 |
| Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
| Ⅶ | 4.00 | a | b | 3∶4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.00 | 1∶1 | 4.65 |


②由实验I和Ⅱ可知,稀释
 溶液,电离平衡
溶液,电离平衡③由实验Ⅱ~Ⅷ可知,增大
 浓度,
浓度, 电离平衡
电离平衡 实验结论:假设成立。
(4)移取
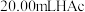 溶液,加入2滴指示剂溶液,用
溶液,加入2滴指示剂溶液,用 溶液滴定至终点,消耗体积为
溶液滴定至终点,消耗体积为 ,则该
,则该 溶液的浓度为0.1104
溶液的浓度为0.1104 。
。①该中和滴定实验应选择
②在
(5)下列操作会导致测定结果偏低的是
a.锥形瓶用待测液润洗
b.装氢氧化钠溶液的滴定管没有润洗
c.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
d.滴定前平视,滴定结束时俯视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】现用 0.1000mol/L KMnO4 酸性溶液滴定未知浓度的无色 H2C2O4 溶液(体积为 20.00mL)。请回答下列问题
(1)该反应的离子方程式是___________________ 。
(2)盛放高锰酸钾溶液的是___ (填“酸式”或“碱式”)滴定管,其原因是___________________ 。
(3)滴定终点的现象为______ 。
(4)若某次滴定开始和结束时,滴定管中的液面如图所示,则终点的读数为___ mL。小明同学根据 3 次实验求得平均消耗高锰酸钾溶液的体积为 VmL,请计算该 H2C2O4溶液的物质的量浓度为___ mol/L
(5)下列操作使测定结果偏低的是___ (填字母)。
A.酸式滴定管未用标准液润洗直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取 KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(1)该反应的离子方程式是
(2)盛放高锰酸钾溶液的是
(3)滴定终点的现象为
(4)若某次滴定开始和结束时,滴定管中的液面如图所示,则终点的读数为

(5)下列操作使测定结果偏低的是
A.酸式滴定管未用标准液润洗直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取 KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】I.亚硫酸盐是一种常见的食品添加剂。
为检验某食品中亚硫酸盐含量(通常以1kg样品中含 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
a.称取样品Wg;
b.向样品中加入足量稀硫酸;
c.将b中产生的 用足量
用足量 溶液吸收;
溶液吸收;
d.将c所得硫酸溶液用氢氧化钠标准液滴定;
e.数据处理。
(1)步骤d中可选用的指示剂为___________ 。下图显示滴定终点时,滴定管(量程为25mL)读数为___________ 。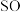 的质量是
的质量是___________ g(用含W、V的代数式表示)。
(3)步骤d中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有___________ (填序号)。
①量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
②装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
③滴定开始读数时仰视读数
II.
(4)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图所示:___________ ,
B电极的电极反应式是___________ 。
(5)以KOH溶液为离子导体,组成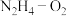 清洁燃料电池的总反应式为
清洁燃料电池的总反应式为_______ 。
为检验某食品中亚硫酸盐含量(通常以1kg样品中含
 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。a.称取样品Wg;
b.向样品中加入足量稀硫酸;
c.将b中产生的
 用足量
用足量 溶液吸收;
溶液吸收;d.将c所得硫酸溶液用氢氧化钠标准液滴定;
e.数据处理。
(1)步骤d中可选用的指示剂为
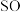 的质量是
的质量是(3)步骤d中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有
①量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
②装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
③滴定开始读数时仰视读数
II.
(4)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图所示:

B电极的电极反应式是
(5)以KOH溶液为离子导体,组成
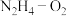 清洁燃料电池的总反应式为
清洁燃料电池的总反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】苯甲酸和苯甲醇是重要的化工原料,可以通过苯甲醛来制备,反应原理如下图。

已知:①反应物、产物及溶剂的主要性质见下表
②RCHO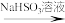
 (不溶于醚,可溶于水)
(不溶于醚,可溶于水)
实验流程如下图:
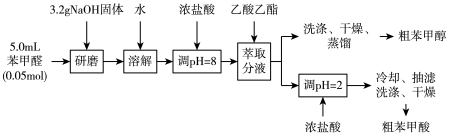
回答下面问题:
(1)苯甲醛和NaOH在__________ (仪器)中研磨;
(2)调pH=8的目的是__________ ;
(3)乙酸乙酯萃取后,取A层液体进行洗涤、干燥、蒸馏,可得粗苯甲醇;用饱和NaHSO3溶液洗涤有机相的目的是__________ ,反应的化学方程式为__________ ;
(4)蒸馏时采取减压蒸馏而不是常压蒸馏的原因是__________ ;
(5)用浓盐酸调pH=2的目的是__________ ;
(6)分离苯甲酸时,抽滤的优点是__________ ,洗涤用的试剂是__________ 。

已知:①反应物、产物及溶剂的主要性质见下表
| 物质 | 相对分子质量 | 熔点 | 沸点 | 溶解性 | 其他性质 |
| 苯甲醛 | 106 | -26℃ | 179℃ | 微溶于水,易溶于有机溶剂。 | 和NaHSO3反应产物溶于水。 |
| 苯甲醇 | 108 | -15℃ | 206℃ | 微溶于水,易溶于有机溶剂。 | 加热时易分子间脱水成醚。 |
| 苯甲酸 | 122 | 122℃ | 249℃ | 在水中溶解度0.21g( 17.5℃)、2.7g(80℃),溶于有机溶剂。 | Ka=6.5×10-5 |
| 乙酸乙酯 | 88 | -84℃ | 77℃ | 微溶于水,易溶于有机溶剂。 | 略 |
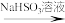
 (不溶于醚,可溶于水)
(不溶于醚,可溶于水)实验流程如下图:

回答下面问题:
(1)苯甲醛和NaOH在
(2)调pH=8的目的是
(3)乙酸乙酯萃取后,取A层液体进行洗涤、干燥、蒸馏,可得粗苯甲醇;用饱和NaHSO3溶液洗涤有机相的目的是
(4)蒸馏时采取减压蒸馏而不是常压蒸馏的原因是
(5)用浓盐酸调pH=2的目的是
(6)分离苯甲酸时,抽滤的优点是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】EDTA二钠盐(用Na2H2Y表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。EDTA的结构简式为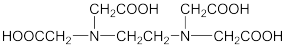 。
。
实验(一):制备Na2H2Y。
步骤1:称取一氯乙酸于三口瓶中,慢慢加入50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤2:如图1所示,在50℃条件下保温小时。
步骤3:将步骤2所得混合物倒入烧杯中,用浓盐酸调节pH至1.2,析出大量白色沉淀。
步骤4:从步骤3所得混合物中分离Na2H2Y,如图所示。

已知:4ClCH2COONa+H2NCH2CH2NH2→(NaOOCCH2)2NCH2CH2N(CH2COONa)2+4HCl。
(1)图1中三口瓶采用___ (填“酒精灯”或“热水浴”)加热。
(2)图1中仪器A的名称是___ ,NaOH的作用是___ 。
(3)仪器B的作用是___ ,进水口是___ (填“a”或“b”)。
(4)用图2装置分离Na2H2Y的优点是___ 。
(5)分离出来的Na2H2Y用___ (填“冷水”、“热水”或“酒精”)洗涤。
实验(二):用Na2H2Y溶液测定饮用水的总硬度。
饮用水的总硬度用Mg2+、Ca2+的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol•L-1的Na2H2Y溶液滴定,三次平行实验测定数据如下:
滴定反应:Ca2++H2Y2-=CaY2-+2H+,Mg2++H2Y2-=MgY2-+2H+。
(6)该饮用水的总硬度为___ mol•L-1。
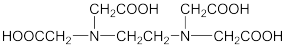 。
。实验(一):制备Na2H2Y。
步骤1:称取一氯乙酸于三口瓶中,慢慢加入50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤2:如图1所示,在50℃条件下保温小时。
步骤3:将步骤2所得混合物倒入烧杯中,用浓盐酸调节pH至1.2,析出大量白色沉淀。
步骤4:从步骤3所得混合物中分离Na2H2Y,如图所示。

已知:4ClCH2COONa+H2NCH2CH2NH2→(NaOOCCH2)2NCH2CH2N(CH2COONa)2+4HCl。
(1)图1中三口瓶采用
(2)图1中仪器A的名称是
(3)仪器B的作用是
(4)用图2装置分离Na2H2Y的优点是
(5)分离出来的Na2H2Y用
实验(二):用Na2H2Y溶液测定饮用水的总硬度。
饮用水的总硬度用Mg2+、Ca2+的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol•L-1的Na2H2Y溶液滴定,三次平行实验测定数据如下:
| 实验 | 起始读数/mL | 终点读数mL |
| I | 0.25 | 26.54 |
| II | 1.20 | 26.10 |
| III | 0.40 | 25.50 |
(6)该饮用水的总硬度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氰化钠(NaCN)是一种基本化工原料,同时也是一种有毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠( )溶液来处理,以轻其对环境的污染。
)溶液来处理,以轻其对环境的污染。
工业制备过硫酸钠的反应原理如下所示
主反应:
副反应:
某化学小组利用上述原理制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如图所示装置制备 。
。

(1)装置中盛放 溶液的仪器的名称是
溶液的仪器的名称是___________ 。
(2)检查装置a气密性的方法:用止水夹夹住a、b之间的橡皮管,向分液漏斗中加水,___________ ,证明装置a气密性良好。
(3)装置a中反应产生的气体需要持续通入装置c的原因是___________ 。
(4)上述装置中还需补充的实验仪器或装置有___________(填字母代号)。
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知;①废水中氰化钠的最高排放标准为0.5mg/L
② ,
, ,AgI呈黄色,
,AgI呈黄色, 优先与
优先与 发生反应。
发生反应。
实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用 的标准
的标准 溶液滴定,消耗
溶液滴定,消耗 溶液的体积为5.00mL。
溶液的体积为5.00mL。
(5)滴定终点的现象是___________ 。
(6)处理后的废水中氰化钠的含量为___________ mg/L。
(7)NaCN用30%的双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是___________ 。
 )溶液来处理,以轻其对环境的污染。
)溶液来处理,以轻其对环境的污染。工业制备过硫酸钠的反应原理如下所示
主反应:

副反应:

某化学小组利用上述原理制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如图所示装置制备
 。
。
(1)装置中盛放
 溶液的仪器的名称是
溶液的仪器的名称是(2)检查装置a气密性的方法:用止水夹夹住a、b之间的橡皮管,向分液漏斗中加水,
(3)装置a中反应产生的气体需要持续通入装置c的原因是
(4)上述装置中还需补充的实验仪器或装置有___________(填字母代号)。
| A.温度计 | B.水浴加热装置 | C.洗气瓶 | D.环形玻璃搅拌棒 |
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知;①废水中氰化钠的最高排放标准为0.5mg/L
②
 ,
, ,AgI呈黄色,
,AgI呈黄色, 优先与
优先与 发生反应。
发生反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用
 的标准
的标准 溶液滴定,消耗
溶液滴定,消耗 溶液的体积为5.00mL。
溶液的体积为5.00mL。(5)滴定终点的现象是
(6)处理后的废水中氰化钠的含量为
(7)NaCN用30%的双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是
您最近一年使用:0次



