已知: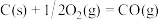
 ;
;
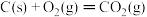

则反应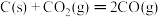 的
的 为:
为:
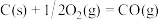
 ;
;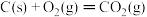

则反应
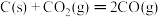 的
的 为:
为:A.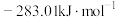 |
B. |
C.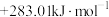 |
D. |
11-12高二上·辽宁锦州·期末 查看更多[13]
(已下线)2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷(已下线)2011-2012学年高二上学期单元测试期中考试化学试卷(已下线)2011-2012学年广东省中山一中高二下学期第一次段考化学试卷(已下线)2012-2013学年江西省赣州市十一县(市)高二上学期期中联考化学试卷2014-2015云南省玉溪第一中学高二上学期期末考试化学试卷2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷2015-2016学年湖南省冷水江一中高二上学期期中(理)化学试卷2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷2020届高三化学知识点强化训练—化学能与热能宁夏青铜峡市高级中学2020-2021学年高二上学期期中考试化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期末考试化学试题新疆乌苏市第一中学2021-2022学年高二上学期期中考试化学试题第一章 第二节 反应热的计算
更新时间:2021-12-02 07:57:29
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
| A.反应①②均为放热反应 |
| B.等物质的量的甲烷分别发生反应①②,转移电子数相同 |
| C.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-a kJ·mol-1,a<574 |
| D.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】工业制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)。
已知在25℃时:①C(s)+ O2(g)⇌CO(g) ∆H1=-111kJ/mol
O2(g)⇌CO(g) ∆H1=-111kJ/mol
②H2(g)+ O2(g)= H2O(g) ∆H2=-242kJ/mol
O2(g)= H2O(g) ∆H2=-242kJ/mol
③C(s)+O2(g)=CO2(g) ∆H3=-394kJ/mol
下列说法不正确的是
已知在25℃时:①C(s)+
 O2(g)⇌CO(g) ∆H1=-111kJ/mol
O2(g)⇌CO(g) ∆H1=-111kJ/mol②H2(g)+
 O2(g)= H2O(g) ∆H2=-242kJ/mol
O2(g)= H2O(g) ∆H2=-242kJ/mol ③C(s)+O2(g)=CO2(g) ∆H3=-394kJ/mol
下列说法不正确的是
| A.25℃时,CO(g)+H2O(g)=CO2(g)+H2(g) ∆H=-41kJ/mol |
| B.增大压强,反应①的平衡常数K减小 |
| C.反应①达到平衡时,每生成1mol CO的同时生成0.5mol O2 |
| D.反应②断开2mol H2和1mol O2中的化学键所吸收的能量比形成4mol O-H键所放出的能量少484 kJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】向100 mL 0.5 mol·L-1 Ba(OH)2溶液中加入足量硫酸铜溶液充分反应后,放出a kJ的热量。如果向100 mL 0.5 mol·L-1 NaOH溶液中加入足量硫酸铜溶液充分反应后,放出b kJ的热量,则硫酸钠溶液与氯化钡溶液反应的热化学方程式为
A.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-(a-b) kJ·mol-1 (aq)=BaSO4(s) △H=-(a-b) kJ·mol-1 |
B.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-20(a-b) kJ·mol-1 (aq)=BaSO4(s) △H=-20(a-b) kJ·mol-1 |
C.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-20(a-2b) kJ·mol-1 (aq)=BaSO4(s) △H=-20(a-2b) kJ·mol-1 |
D.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-20(2a-b) kJ·mol-1 (aq)=BaSO4(s) △H=-20(2a-b) kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
反应Ⅰ:
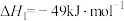
反应Ⅱ:
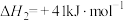
反应Ⅲ:
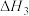
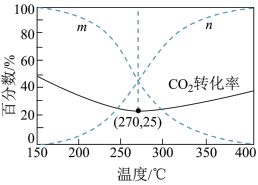
在5MPa下,按照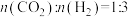 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图。下列说法正确的是
的转化率随温度的变化如图。下列说法正确的是
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:反应Ⅰ:

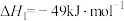
反应Ⅱ:

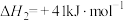
反应Ⅲ:

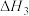
在5MPa下,按照
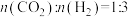 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图。下列说法正确的是
的转化率随温度的变化如图。下列说法正确的是
| A.反应Ⅲ中反应物的总键能大于生成物的总键能 |
B.曲线 代表CO在含碳产物中物质的量分数 代表CO在含碳产物中物质的量分数 |
C.该条件下温度越低,越有利于工业生产 |
D.图示270℃时,平衡体系中 的体积分数约为66.6% 的体积分数约为66.6% |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】2021年我国科学家以 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
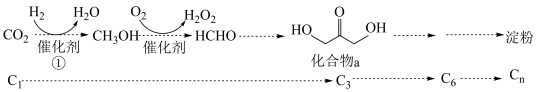
①
②
③
④
 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①

②

③

④

| A.第①步反应断裂了非极性键与极性键 |
| B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度 |
C. |
| D.反应④是吸热反应,活化能较大,所以是决速步 |
您最近一年使用:0次

 ,已知下列几种物质的标准摩尔生成焓(在
,已知下列几种物质的标准摩尔生成焓(在 时,由最稳定单质合成
时,由最稳定单质合成 指定产物的反应热):
指定产物的反应热):





 ℃时,
℃时,

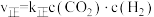 ,
, ,
, 、
、 为速率常数。
为速率常数。

 的
的
 时,
时, ,则
,则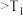 ℃
℃

