以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
反应Ⅰ:
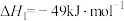
反应Ⅱ:
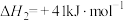
反应Ⅲ:
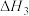
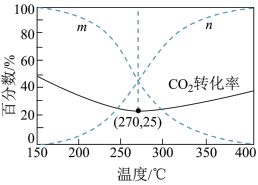
在5MPa下,按照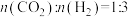 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图。下列说法正确的是
的转化率随温度的变化如图。下列说法正确的是
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:反应Ⅰ:

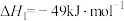
反应Ⅱ:

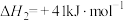
反应Ⅲ:

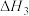
在5MPa下,按照
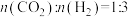 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图。下列说法正确的是
的转化率随温度的变化如图。下列说法正确的是
| A.反应Ⅲ中反应物的总键能大于生成物的总键能 |
B.曲线 代表CO在含碳产物中物质的量分数 代表CO在含碳产物中物质的量分数 |
C.该条件下温度越低,越有利于工业生产 |
D.图示270℃时,平衡体系中 的体积分数约为66.6% 的体积分数约为66.6% |
更新时间:2023-04-25 10:04:35
|
相似题推荐
【推荐1】高温条件下C40H20生成C40H18的反应历程和相对能量变化如图所示:
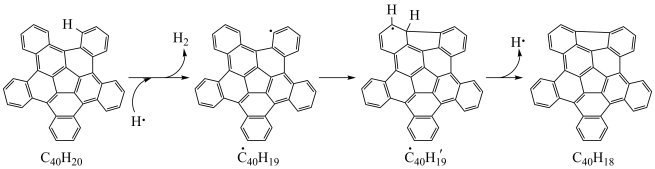
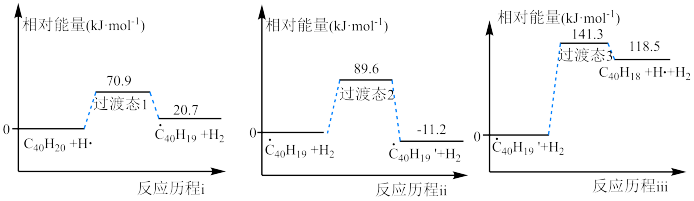
| A.三步反应历程中决定总反应速率的是反应历程ⅲ |
B.ⅰ、ⅱ、ⅲ三步的总反应为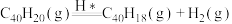  kJ⋅mol kJ⋅mol |
| C.根据图像可以判断过渡状态1、2、3的稳定性相对高低 |
| D. C40H18形成的过程中有极性键的断裂和形成 |
您最近一年使用:0次
【推荐2】已知:

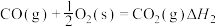


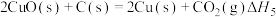
下列关于上述反应焓变的判断正确的是

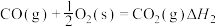


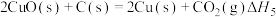
下列关于上述反应焓变的判断正确的是

A.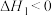 | B. |
C.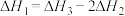 | D.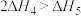 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】 的资源化利用有利于缓解温室效应并解决能源转化问题,一种以
的资源化利用有利于缓解温室效应并解决能源转化问题,一种以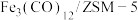 催化
催化 加氢
加氢 合成低碳烯烃的反应过程如下图所示:
合成低碳烯烃的反应过程如下图所示:

下列说法正确的是。
 的资源化利用有利于缓解温室效应并解决能源转化问题,一种以
的资源化利用有利于缓解温室效应并解决能源转化问题,一种以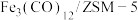 催化
催化 加氢
加氢 合成低碳烯烃的反应过程如下图所示:
合成低碳烯烃的反应过程如下图所示:
下列说法正确的是。
| A.决定整个反应快慢的是第ⅱ步 |
| B.第ⅱ步反应过程中形成了非极性键 |
C.该反应总过程即 加氢合成低碳烯烃的原子利用率为100% 加氢合成低碳烯烃的原子利用率为100% |
D.催化剂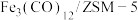 的使用可以提高低碳烯烃的产率 的使用可以提高低碳烯烃的产率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】一定温度下,在某固定容积的密闭容器中发生反应: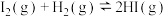 ,改变下列条件,能加快反应速率的是
,改变下列条件,能加快反应速率的是
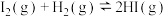 ,改变下列条件,能加快反应速率的是
,改变下列条件,能加快反应速率的是A.充入一定量 | B.充入一定量 ,增大压强 ,增大压强 |
| C.降低温度 | D.分离出 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是。
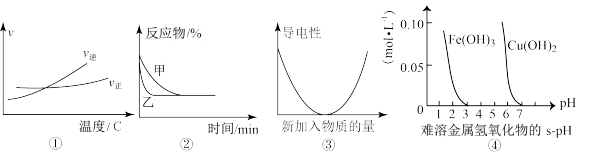

A.根据图①可判断可逆反应 的 的 |
B.图②表示压强对可逆反应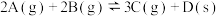 的影响,乙的压强大 的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D.根据图④,若除去 溶液中的 溶液中的 可采用向溶液中加入适量 可采用向溶液中加入适量 ,至 ,至 在4左右 在4左右 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】在某恒定温度下,向容积为1L的容器中投入1mol CO和2mol H2O,发生如下反应:CO(g)+H2O(g)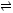 CO2(g)+H2(g),平衡时生成CO2
CO2(g)+H2(g),平衡时生成CO2  mol.若保持温度和容积不变,向其中增加2mol H2O(g),使反应到达新的平衡,下列说法不正确的是
mol.若保持温度和容积不变,向其中增加2mol H2O(g),使反应到达新的平衡,下列说法不正确的是
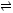 CO2(g)+H2(g),平衡时生成CO2
CO2(g)+H2(g),平衡时生成CO2  mol.若保持温度和容积不变,向其中增加2mol H2O(g),使反应到达新的平衡,下列说法不正确的是
mol.若保持温度和容积不变,向其中增加2mol H2O(g),使反应到达新的平衡,下列说法不正确的是| A.新、旧平衡时容器内气体的压强之比是5:3 |
| B.新平衡时H2O的转化率为20% |
| C.新平衡时CO的浓度是0.2 mol•L﹣1 |
| D.新、旧平衡时容器内气体密度之比为5:3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g) 2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表:
2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表:
下列说法正确的是
 2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表:
2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表:| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
| A.K3>K2=K1 |
| B.实验Ⅱ可能压缩体积 |
| C.实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动 |
D.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的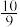 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】在合成氨工业中,原料气( 、
、 及少量
及少量 、
、 的混合气)在进入合成塔前,需经过铜氨液处理,目的是除去其中的
的混合气)在进入合成塔前,需经过铜氨液处理,目的是除去其中的 ,其反应为:
,其反应为: 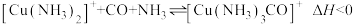 ,下列有关说法
,下列有关说法不正确 的是
 、
、 及少量
及少量 、
、 的混合气)在进入合成塔前,需经过铜氨液处理,目的是除去其中的
的混合气)在进入合成塔前,需经过铜氨液处理,目的是除去其中的 ,其反应为:
,其反应为: 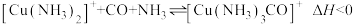 ,下列有关说法
,下列有关说法A.铜氨液吸收 适宜的生产压强是高压 适宜的生产压强是高压 |
| B.铜氨液再生适宜的生产温度是低温 |
C.工业合成氨选择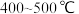 下进行,是因为铁触媒在 下进行,是因为铁触媒在 左右时活性最大 左右时活性最大 |
| D.通过改变反应条件可以使一个可能发生的反应按照某一方向进行 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】生产环氧乙烷( )的反应为
)的反应为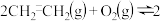
 (g)
(g) 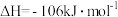 。其反应机理如下:
。其反应机理如下:
①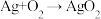 慢
慢
②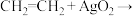

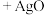 快
快
③ 快
快
下列有关该反应的说法正确的是
 )的反应为
)的反应为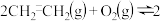
 (g)
(g) 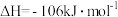 。其反应机理如下:
。其反应机理如下:①
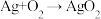 慢
慢②
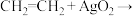

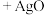 快
快③
 快
快下列有关该反应的说法正确的是
A.反应的活化能等于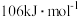 |
B.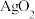 也是该反应的催化剂 也是该反应的催化剂 |
| C.增大乙烯的浓度能显著提高环氧乙烷的生成速率 |
| D.该反应的原子利用率为100% |
您最近一年使用:0次

 (g)+H2(g)→CH3CH2CH3(g) △H=-157 kJ/mol。已知环丙烷(g)的燃烧热△H=-2092 kI/mol,丙烷(g)的燃烧热△H=-2220 kJ/mol,1 mol液态水蒸发为气态水的焓变为△H=+44 kJ/mol。则 2 mol氢气完全燃烧生成气态水的△H(kJ/mol)为
(g)+H2(g)→CH3CH2CH3(g) △H=-157 kJ/mol。已知环丙烷(g)的燃烧热△H=-2092 kI/mol,丙烷(g)的燃烧热△H=-2220 kJ/mol,1 mol液态水蒸发为气态水的焓变为△H=+44 kJ/mol。则 2 mol氢气完全燃烧生成气态水的△H(kJ/mol)为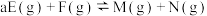 ,平衡常数K等于1,在温度不变的情况下将容器的体积扩大为原来的2倍,F百分含量不发生变化,则E的平衡转化率为
,平衡常数K等于1,在温度不变的情况下将容器的体积扩大为原来的2倍,F百分含量不发生变化,则E的平衡转化率为 放出热量38.8kJ,在
放出热量38.8kJ,在 存在的条件下加热
存在的条件下加热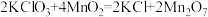
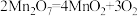 ↑快
↑快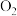 所具有的总能量
所具有的总能量 混合加热,充分反应后
混合加热,充分反应后

