含氯消毒剂可有效灭活新冠病毒,为新冠疫情防控做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。二氧化氯(ClO2)是黄绿色易溶于水的气体,熔点-59°C,沸点11°C,但其浓度过高时易分解爆炸,故常采用H2O2和NaOH混合溶液将其吸收转化为NaClO2固体便于运输和贮存。现利用如下装置及试剂制备。
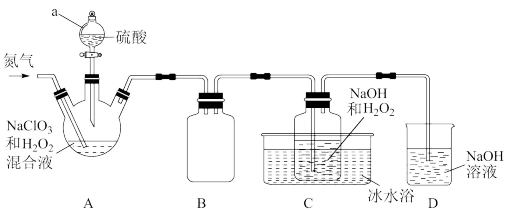
请回答下列问题:
(1)仪器a的名称为___________ ,装置A中反应的化学方程式为___________ 。
(2)通入氮气的主要作用___________ 、___________ 。
(3)装置B的作用是___________ 。装置D的作用是___________ 。
(4)一段时间后,C装置中有NaClO2晶体析出,则C装置中发生的离子反应方程式为___________ ,冰水浴冷却的目的是___________ 。
(5)测定NaClO2样品的纯度:取C中NaClO2晶体5.0g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20mol·L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL。(已知:I2+2 =
= +2I-)
+2I-)
①滴定终点的现象:___________ 。
②试计算NaClO2样品的纯度___________ 。

请回答下列问题:
(1)仪器a的名称为
(2)通入氮气的主要作用
(3)装置B的作用是
(4)一段时间后,C装置中有NaClO2晶体析出,则C装置中发生的离子反应方程式为
(5)测定NaClO2样品的纯度:取C中NaClO2晶体5.0g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20mol·L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL。(已知:I2+2
 =
= +2I-)
+2I-)①滴定终点的现象:
②试计算NaClO2样品的纯度
更新时间:2021-12-31 12:40:09
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】过氧化氢的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某同学取一定量的过氧化氢溶液,通过滴定法测定了过氧化氢的含量。请填写下列空白:
(1)移取25.00 mL密度为1.00g·mL−1的过氧化氢溶液至250mL______ (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用0.1mol/L高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写完整。
□ +□H2O2+□H+=□Mn2++□H2O+□
+□H2O2+□H+=□Mn2++□H2O+□________
(3)滴定前,取______ (填“酸式”或“碱式”)滴定管,水洗后要______ (填操作名称),再注入高锰酸钾标准溶液,调整滴定管的尖嘴充满液体。如图,滴定管的读数方法正确的是______ (填“A”、“B”或“C”)。

(4)滴定终点的现象是_______ 。
(5)重复滴定三次,数据如下表:
平均耗用高锰酸钾标准溶液的体积V为_______ mL,原过氧化氢溶液中过氧化氢的浓度为_______ 。
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______ (填“偏高”、“偏低”或“不变”)。
(1)移取25.00 mL密度为1.00g·mL−1的过氧化氢溶液至250mL
(2)用0.1mol/L高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写完整。
□
 +□H2O2+□H+=□Mn2++□H2O+□
+□H2O2+□H+=□Mn2++□H2O+□(3)滴定前,取

(4)滴定终点的现象是
(5)重复滴定三次,数据如下表:
滴定序号 | 待测过氧化氢溶液体积/mL | 高锰酸钾标准溶液体积 | 平均耗用高锰酸钾标准溶液 | |
V1/mL | V2/mL | V /mL | ||
第1次 | 25.00 | 1.00 | 19.60 | |
第2次 | 25.00 | 19.60 | 34.20 | |
第3次 | 25.00 | 0.50 | 14.90 | |
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E、F为短周期元素, 原子序数依次增大。非金属元素A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。E+与D2-具有相同的电子层结构。A单质在F单质中燃烧,产物溶于水得到一种强酸M。回答下列问题:
(1)画出E的离子结构示意图___________ 。
(2)F在周期表中的位置是___________ 。
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为___________ 。
(4)由这些元素组成的物质,相关信息如下:
①a的电子式为___________ 。 写出其与水反应的化学方程式:___________ 。
②b的一种常见用途为___________ 。
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为___________ 。
(1)画出E的离子结构示意图
(2)F在周期表中的位置是
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为
(4)由这些元素组成的物质,相关信息如下:
| 物质 | 组成和结构信息 |
| a | 由 A、E组成的离子化合物 |
| b | 由D、E组成的含非极性键的离子化合物,阴阳离子数之比为1:2 |
| c | 化学式为BDF2的共价化合物 |
②b的一种常见用途为
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。实验步骤如下

①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为__________ ;步骤②中,水浴加热的优点为___________ 。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:_____ C6H12O6+______ HNO3
______ H2C2O4+9NO2↑+3NO↑+_________
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a mol/LKMnO4标准液滴定,只发生5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为V mL,则所得草酸晶体(H2C2O4·2H2O)的纯度为_________ 。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择右侧装置验证产物CO2,装置B的主要作用是_______________ 。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为验证是否有CO,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。



①乙同学的实验装置中,依次连接的合理顺序为A、B、_________ 。其中装置H反应管中盛有的物质是_____________ 。(写化学式)
②能证明草酸晶体分解产物中有CO的现象是______________ 。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。实验步骤如下

①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:

(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a mol/LKMnO4标准液滴定,只发生5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为V mL,则所得草酸晶体(H2C2O4·2H2O)的纯度为
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择右侧装置验证产物CO2,装置B的主要作用是
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为验证是否有CO,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。



①乙同学的实验装置中,依次连接的合理顺序为A、B、
②能证明草酸晶体分解产物中有CO的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题:

(1)检查装置气密性并加入WO3。先通N2,其目的是____ ;一段时间后,加热管式炉,改通H2,对B处逸出的H2进行后续处理。仪器A的名称为____ 。
(2)WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是____ ;操作④是____ ,目的是____ 。
(3)利用碘量法测定WCl6产品纯度,实验如下:称量待测样品mg,先将WCl6转化为可溶的Na2WO4,通过 离子交换柱发生反应:
离子交换柱发生反应: 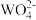 +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 。交换结束后,向所得含
。交换结束后,向所得含 的溶液中加入适量酸化的KI溶液,发生反应:
的溶液中加入适量酸化的KI溶液,发生反应: +5I-+6H+=3I2+3H2O;反应完全后,用淀粉溶液作指示剂,cmol•L-1的Na2S2O3标准溶液滴定,发生反应:I2+2
+5I-+6H+=3I2+3H2O;反应完全后,用淀粉溶液作指示剂,cmol•L-1的Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+  。滴定达终点时消耗Na2S2O3溶液VmL,则滴定终点时的实验现象是
。滴定达终点时消耗Na2S2O3溶液VmL,则滴定终点时的实验现象是____ ,该样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为____ 。

(1)检查装置气密性并加入WO3。先通N2,其目的是
(2)WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是
(3)利用碘量法测定WCl6产品纯度,实验如下:称量待测样品mg,先将WCl6转化为可溶的Na2WO4,通过
 离子交换柱发生反应:
离子交换柱发生反应: 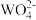 +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 。交换结束后,向所得含
。交换结束后,向所得含 的溶液中加入适量酸化的KI溶液,发生反应:
的溶液中加入适量酸化的KI溶液,发生反应: +5I-+6H+=3I2+3H2O;反应完全后,用淀粉溶液作指示剂,cmol•L-1的Na2S2O3标准溶液滴定,发生反应:I2+2
+5I-+6H+=3I2+3H2O;反应完全后,用淀粉溶液作指示剂,cmol•L-1的Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+  。滴定达终点时消耗Na2S2O3溶液VmL,则滴定终点时的实验现象是
。滴定达终点时消耗Na2S2O3溶液VmL,则滴定终点时的实验现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】从冶炼金属产生的某酸泥(含 单质,
单质, 及锌、铜的化合物等)中回收汞和硒的一种工艺如下:
及锌、铜的化合物等)中回收汞和硒的一种工艺如下: 、
、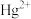 、
、 、
、 形式进入溶液。
形式进入溶液。 固体的晶体类型与石墨的晶体类型
固体的晶体类型与石墨的晶体类型___________ 相同(填“是”或者“不”);分离氧化浸出液和浸出渣的操作是___________ 。
2.还原沉汞时加入的 属于正盐,则
属于正盐,则 属于
属于___________ 元酸:沉汞后溶液中磷以最高价形式存在,“还原沉汞”的主要反应中氧化剂和还原剂的物质的量之比为___________ 。
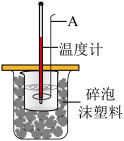
3.实验室测定中和反应热效应的装置如图所示,该装置有利于减少实验误差的设计措施有___________ (至少写一条)。
i.取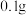 粗硒于锥形瓶中,加入
粗硒于锥形瓶中,加入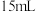 浓盐酸和
浓盐酸和 浓硝酸,沸水浴加热,使
浓硝酸,沸水浴加热,使 全部转化为
全部转化为 ;
;
ii.除去过量的 和溶解的
和溶解的 ;
;
iii. 加入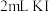 溶液、
溶液、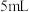 淀粉溶液,然后用
淀粉溶液,然后用 标准溶液进行滴定,到达滴定终点时,消耗
标准溶液进行滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。
。
已知:
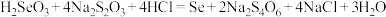
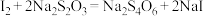
4.滴定时使用的定量仪器为___________ ,到达滴定终点时的现象为___________ 。
5.根据实验数据计算粗硒中硒的纯度为___________ 。
 单质,
单质, 及锌、铜的化合物等)中回收汞和硒的一种工艺如下:
及锌、铜的化合物等)中回收汞和硒的一种工艺如下: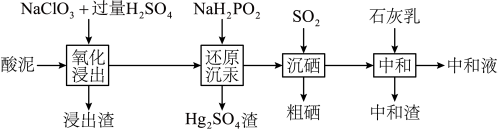
 、
、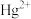 、
、 、
、 形式进入溶液。
形式进入溶液。 固体的晶体类型与石墨的晶体类型
固体的晶体类型与石墨的晶体类型2.还原沉汞时加入的
 属于正盐,则
属于正盐,则 属于
属于3.实验室测定中和反应热效应的装置如图所示,该装置有利于减少实验误差的设计措施有
i.取
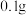 粗硒于锥形瓶中,加入
粗硒于锥形瓶中,加入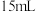 浓盐酸和
浓盐酸和 浓硝酸,沸水浴加热,使
浓硝酸,沸水浴加热,使 全部转化为
全部转化为 ;
;ii.除去过量的
 和溶解的
和溶解的 ;
;iii. 加入
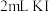 溶液、
溶液、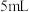 淀粉溶液,然后用
淀粉溶液,然后用 标准溶液进行滴定,到达滴定终点时,消耗
标准溶液进行滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。
。已知:

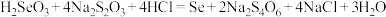
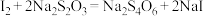
4.滴定时使用的定量仪器为
5.根据实验数据计算粗硒中硒的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】绿矾中FeSO4·7H2O含量的测定,若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
实验方案如下:①称取15.041g绿矾产品,溶解,在250mL容量瓶中定容。
②量取25.00mL 待测溶液于锥形瓶中。
③用0.0500mol/LKMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
(1)上述实验方案中的步骤④是______ 。洁净的滴定管在滴定前必须进行的操作有:
①检验活塞是否漏水;
②_______ ;
③向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
【数据处理】某小组同学的实验数据记录如下:
(2)上述样品中FeSO4·7H2O的质量分数为_______ (用小数表示,保留三位小数)。
实验方案如下:①称取15.041g绿矾产品,溶解,在250mL容量瓶中定容。
②量取25.00mL 待测溶液于锥形瓶中。
③用0.0500mol/LKMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
(1)上述实验方案中的步骤④是
①检验活塞是否漏水;
②
③向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
【数据处理】某小组同学的实验数据记录如下:
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.20 | 21.40 |
| 2 | 0.00 | 21.00 |
| 3 | 1.60 | 26.60 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
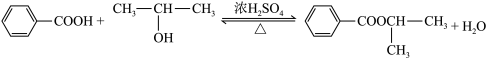
【推荐1】苯甲酸乙酯( )稍有水果气味,可用作有机合成中间体、溶剂等。某化学兴趣小组用制取乙酸乙酯的原理制取苯甲酸乙酯。
)稍有水果气味,可用作有机合成中间体、溶剂等。某化学兴趣小组用制取乙酸乙酯的原理制取苯甲酸乙酯。
已知:①乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH 。
②“环己烷-乙醇-水”会形成“共沸物”,其沸点为62.6℃。
③有关物质的沸点如下
I.粗产品制取:
在反应容器中加入一定量的苯甲酸、 乙醇、环己烷,再加入适量的浓硫酸,混合均匀并加入沸石,小心加热进行反应,获得苯甲酸乙酯粗产品。
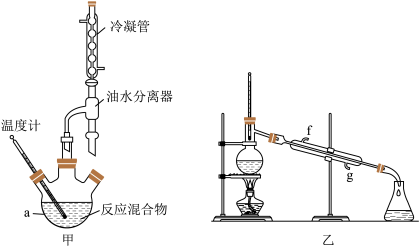
(1)仪器a的名称是___________ ,仪器b的作用是___________ 。
(2)甲、乙两套合成装置更合适的是___________ 。

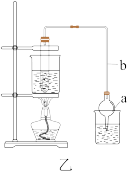
II. 粗产品提纯:

(3)操作②的名称是___________ 。
(4)步骤②加入无水CaCl2的作用___________ 。
 )稍有水果气味,可用作有机合成中间体、溶剂等。某化学兴趣小组用制取乙酸乙酯的原理制取苯甲酸乙酯。
)稍有水果气味,可用作有机合成中间体、溶剂等。某化学兴趣小组用制取乙酸乙酯的原理制取苯甲酸乙酯。已知:①乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH 。
②“环己烷-乙醇-水”会形成“共沸物”,其沸点为62.6℃。
③有关物质的沸点如下
| 物质 | 乙醇 | 环己烷 | 苯甲酸乙酯 | 苯甲酸 |
| 沸点 | 78.3℃ | 80.8℃ | 212.6℃ | 249℃ |
在反应容器中加入一定量的苯甲酸、 乙醇、环己烷,再加入适量的浓硫酸,混合均匀并加入沸石,小心加热进行反应,获得苯甲酸乙酯粗产品。
(1)仪器a的名称是
(2)甲、乙两套合成装置更合适的是


II. 粗产品提纯:

(3)操作②的名称是
(4)步骤②加入无水CaCl2的作用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学兴趣小组设计图甲装置制备苯甲酸异丙酯,其反应原理如下:
实验步骤:
步骤i.在图甲干燥的仪器a中加入24.4g苯甲酸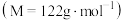 、20mL异丙醇和10mL浓硫酸,再加入几粒沸石;
、20mL异丙醇和10mL浓硫酸,再加入几粒沸石;
步骤ii.加热至70℃左右保持恒温半小时;
步骤iii.将图甲的仪器a中的液体混合物进行如下操作得到粗产品:
回答下列问题:
(1)图甲中仪器a的名称为___________ ,步骤i中选择的仪器a的容积大小为___________ (填标号)。
A.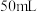 B.
B. C.
C. D.
D.
(2)实验中,加入的异丙醇需过量,其目的是___________ 。判断酯化反应接近反应限度的现象为___________ 。
(3)本实验一般可采用的加热方式为___________ 。
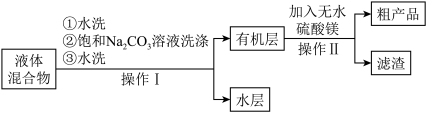
(4)操作Ⅰ中饱和碳酸钠溶液洗涤的目的是___________ ,操作Ⅱ中加入无水硫酸镁的作用为___________ 。
(5)步骤iv操作时应收集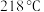 的馏分,如果温度计水银球位置偏上,则收集的精制产品中可能混有的杂质为
的馏分,如果温度计水银球位置偏上,则收集的精制产品中可能混有的杂质为___________ (填物质名称)。
(6)如果得到的苯甲酸异丙酯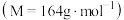 的质量为
的质量为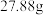 ,那么该实验的产率为
,那么该实验的产率为___________ %(保留3位有效数字)。
| 物质 | 相对分子质量 | 密度/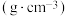 | 沸点/℃ | 水溶性 |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 异丙醇 | 60 | 0.79 | 82 | 易溶 |
| 苯甲酸异丙酯 | 164 | 1.08 | 218 | 不溶 |
步骤i.在图甲干燥的仪器a中加入24.4g苯甲酸
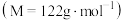 、20mL异丙醇和10mL浓硫酸,再加入几粒沸石;
、20mL异丙醇和10mL浓硫酸,再加入几粒沸石;步骤ii.加热至70℃左右保持恒温半小时;
步骤iii.将图甲的仪器a中的液体混合物进行如下操作得到粗产品:
回答下列问题:
(1)图甲中仪器a的名称为
A.
 B.
B. C.
C. D.
D.
(2)实验中,加入的异丙醇需过量,其目的是
(3)本实验一般可采用的加热方式为
(4)操作Ⅰ中饱和碳酸钠溶液洗涤的目的是
(5)步骤iv操作时应收集
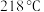 的馏分,如果温度计水银球位置偏上,则收集的精制产品中可能混有的杂质为
的馏分,如果温度计水银球位置偏上,则收集的精制产品中可能混有的杂质为(6)如果得到的苯甲酸异丙酯
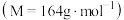 的质量为
的质量为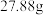 ,那么该实验的产率为
,那么该实验的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.如图所示为常见仪器的部分结构。
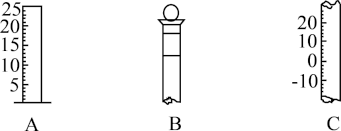
(1)写出下列仪器的名称:
A____________ ,B____________ ,C____________ 。
(2)仪器B上标有____________ (填标号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用质量分数为98%的浓硫酸(密度为 )来配制220 mL 0.2
)来配制220 mL 0.2 的稀硫酸。
的稀硫酸。
有关操作:①计算所需浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(3)用量筒量取的浓硫酸的体积是___________ mL。
(4)第③步中稀释浓硫酸的操作是_______________________________________ 。
(5)将所配制的稀硫酸进行测定,发现实际浓度大于 。会引起所配溶液浓度偏大的操作有
。会引起所配溶液浓度偏大的操作有______________ (填标号)。
A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.烧杯中稀溶液往容量瓶中转移时,有少量液体溅出
E.定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线

(1)写出下列仪器的名称:
A
(2)仪器B上标有
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用质量分数为98%的浓硫酸(密度为
 )来配制220 mL 0.2
)来配制220 mL 0.2 的稀硫酸。
的稀硫酸。有关操作:①计算所需浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(3)用量筒量取的浓硫酸的体积是
(4)第③步中稀释浓硫酸的操作是
(5)将所配制的稀硫酸进行测定,发现实际浓度大于
 。会引起所配溶液浓度偏大的操作有
。会引起所配溶液浓度偏大的操作有A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.烧杯中稀溶液往容量瓶中转移时,有少量液体溅出
E.定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可以发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,即可以完成高温下Fe与水蒸气的反应实验,请回答下列问题:

(1)写出反应的化学方程式____ 。
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是___ 。
(3)酒精灯和酒精喷灯点燃的顺序是先点燃___ ,理由是___ 。
(4)试管收集到的气体是__ ,如果要在A处点燃气体,则必须对该气体进行__ 。

(1)写出反应的化学方程式
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是
(3)酒精灯和酒精喷灯点燃的顺序是先点燃
(4)试管收集到的气体是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】碳酰氯( )俗名光气,常温下为无色气体,有腐草味,常用作有机合成、农药、药物、染料及其他化工制品的中间体,某实验小组同学选用下图实验装置利用氧气和氯仿合成碳酰氯。
)俗名光气,常温下为无色气体,有腐草味,常用作有机合成、农药、药物、染料及其他化工制品的中间体,某实验小组同学选用下图实验装置利用氧气和氯仿合成碳酰氯。
已知:光气熔点为-118℃,沸点为8.2℃,回答下列问题:
(1)盛放氯仿的容器名称为___________ ,丙装置的作用是___________ ,以上装置的正确连接顺序为c→___________ →d(用a→b→c的形式表示,装置可重复使用)。
(2)装置丁中采用冰水混合物的目的是:___________ ,光气有毒,一旦泄露可用水吸收,生成一种氧化物和氢化物,请写出该化学反应方程式___________
(3)以光气为中间体可以经过一系列的转化合成1-丁醇粗产品(含有少量正丁醛)。为纯化1-丁醇,小组查文献得知:① ;
;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线,

则试剂1为___________ ,操作2为___________ 。
 )俗名光气,常温下为无色气体,有腐草味,常用作有机合成、农药、药物、染料及其他化工制品的中间体,某实验小组同学选用下图实验装置利用氧气和氯仿合成碳酰氯。
)俗名光气,常温下为无色气体,有腐草味,常用作有机合成、农药、药物、染料及其他化工制品的中间体,某实验小组同学选用下图实验装置利用氧气和氯仿合成碳酰氯。 |  | 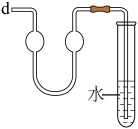 | 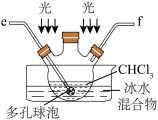 |
| 甲 | 乙 | 丙 | 丁 |
(1)盛放氯仿的容器名称为
(2)装置丁中采用冰水混合物的目的是:
(3)以光气为中间体可以经过一系列的转化合成1-丁醇粗产品(含有少量正丁醛)。为纯化1-丁醇,小组查文献得知:①
 ;
;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线,

则试剂1为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验装置及实验操作是化学实验的基本内容。
(1)请将体现下列实验操作目的的正确选项,填在对应的横线上。
A.防止药品污染
B.防止试管破裂
C.防止实验误差
加热试管时,先均匀加热后集中加热_____ (填序号,下同),滴管使用后,及时清洗并放在试管架上____ ,量取液体时,视线与凹液面最低处保持水平_____ 。
(2)实验室量取70 mL液体,应选用的量筒规格是_____ 。
A.10 mL B.5 mL
C.50 mL D.100 mL
(3)下图是实验室常用的托盘天平。

①该托盘天平能精确到_____ g。
②某同学要称取11.1 g某固体物质,在称量时将物质和砝码位置颠倒,其他操作正确,则称量物质的实际质量_____ (填“大于”“小于”或“等于”)11.1 g。
(4)某试管内装有约占其容积的溶液,则此溶液的体积是______ (用字母回答)。
A.约1 mL
B.约3 mL
C.无法判断
理由:______________________ 。
(5)拟在烧杯中于加热条件下配制某溶液50 mL,应选择的烧杯是______ (用字母回答)。
A.400 mL烧杯
B.250 mL烧杯
C.100 mL烧杯
D.50 mL烧杯
理由:______________________ 。
(1)请将体现下列实验操作目的的正确选项,填在对应的横线上。
A.防止药品污染
B.防止试管破裂
C.防止实验误差
加热试管时,先均匀加热后集中加热
(2)实验室量取70 mL液体,应选用的量筒规格是
A.10 mL B.5 mL
C.50 mL D.100 mL
(3)下图是实验室常用的托盘天平。

①该托盘天平能精确到
②某同学要称取11.1 g某固体物质,在称量时将物质和砝码位置颠倒,其他操作正确,则称量物质的实际质量
(4)某试管内装有约占其容积的溶液,则此溶液的体积是
A.约1 mL
B.约3 mL
C.无法判断
理由:
(5)拟在烧杯中于加热条件下配制某溶液50 mL,应选择的烧杯是
A.400 mL烧杯
B.250 mL烧杯
C.100 mL烧杯
D.50 mL烧杯
理由:
您最近一年使用:0次



