某学生用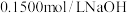 溶液滴定某未知浓度的盐酸溶液,其操作可分解为如下几步:
溶液滴定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.检查滴定管是否漏水
B.用蒸馏水洗净滴定管
C.取下碱式滴定管用标准 溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
溶液润洗后,将标准液注入碱式滴定管“0”刻度以上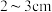 处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.___________
E.用酸式滴定管取稀盐酸 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作 次
次
完成以下填空:
(1)操作D的具体内容是___________ 。
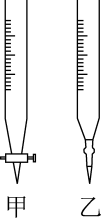
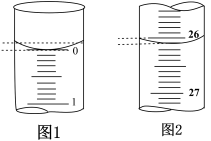
(2)操作C中应该选择图中滴定管___________ (填“甲”或“乙”)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察___________ 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为___________  (精确至0.0001)。
(精确至0.0001)。
(5)下列操作会导致测定结果偏高的是___________
A.锥形瓶洗净后用待测液润洗
B.碱式滴定管在装液前未用标准 溶液润洗
溶液润洗
C.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
D.达到滴定终点时,仰视读数
E.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
F.锥形瓶洗净后残留有一部分蒸馏水
(6)氧化还原滴定与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①将 血液用蒸馏水稀释后,向其中加入足量草酸铵
血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成
晶体,反应生成 沉淀,将沉淀用稀硫酸处理得
沉淀,将沉淀用稀硫酸处理得 溶液。
溶液。
②将①得到的 溶液,再用酸性
溶液,再用酸性 溶液滴定,氧化产物为
溶液滴定,氧化产物为 ,还原产物为
,还原产物为 。
。
③终点时用去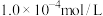 的
的 ,溶液
,溶液 。
。
I:写出酸性高锰酸钾与草酸反应的离子方程式___________ 。
II:判断滴定终点的现象是___________ 。
III:计算血液中钙离子的浓度为___________  。
。
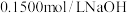 溶液滴定某未知浓度的盐酸溶液,其操作可分解为如下几步:
溶液滴定某未知浓度的盐酸溶液,其操作可分解为如下几步:A.检查滴定管是否漏水
B.用蒸馏水洗净滴定管
C.取下碱式滴定管用标准
 溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
溶液润洗后,将标准液注入碱式滴定管“0”刻度以上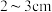 处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下D.___________
E.用酸式滴定管取稀盐酸
 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作
 次
次完成以下填空:
(1)操作D的具体内容是
(2)操作C中应该选择图中滴定管

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.30 | 20.30 |
| 3 | 25.00 | 0.20 | 20.19 |
 (精确至0.0001)。
(精确至0.0001)。(5)下列操作会导致测定结果偏高的是
A.锥形瓶洗净后用待测液润洗
B.碱式滴定管在装液前未用标准
 溶液润洗
溶液润洗C.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
D.达到滴定终点时,仰视读数
E.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
F.锥形瓶洗净后残留有一部分蒸馏水
(6)氧化还原滴定与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①将
 血液用蒸馏水稀释后,向其中加入足量草酸铵
血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成
晶体,反应生成 沉淀,将沉淀用稀硫酸处理得
沉淀,将沉淀用稀硫酸处理得 溶液。
溶液。②将①得到的
 溶液,再用酸性
溶液,再用酸性 溶液滴定,氧化产物为
溶液滴定,氧化产物为 ,还原产物为
,还原产物为 。
。③终点时用去
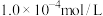 的
的 ,溶液
,溶液 。
。I:写出酸性高锰酸钾与草酸反应的离子方程式
II:判断滴定终点的现象是
III:计算血液中钙离子的浓度为
 。
。
更新时间:2021-12-04 09:39:22
|
相似题推荐
【推荐1】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________ ,乙中的反应:_____________________ 。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________ ,丁装置的目的是________________________ ;干燥管Ⅱ的作用是______________________ 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____ (填“偏高”或“偏低”),简述可能的原因:______________________ 。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________ 。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】马日夫盐[Mn(H2PO4)2·2H2O]主要用作磷化剂;以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
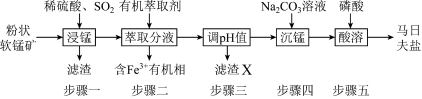
(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O的化学名称为___ 。
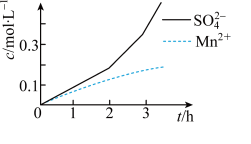
(2)步骤一中,MnO2被SO2和___ 还原。若SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,科研人员认为Mn2+对O2与H2SO3反应起催化作用,其理由是__ 。
(3)滤渣X主要成分为___ ;步骤三调节pH时,最适宜加入的物质是__ 。
A.过量稀盐酸 B.适量Na2CO3溶液
C.适量磷酸溶液 D.过量CaCO3
(4)在沉锰过程中,应将Na2CO3溶液逐量加入锰盐溶液中,如果颠倒试剂混合顺序会有Mn(OH)2生成,其原因是Na2CO3溶液具有较强__ 性;步骤五产生马日夫盐晶体的化学反应方程式为__ 。
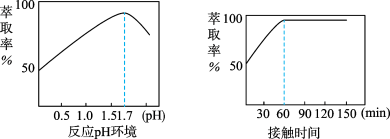
(5)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为____ 。
(6)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是__ (用相关化学用语回答)。

(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O的化学名称为
(2)步骤一中,MnO2被SO2和

(3)滤渣X主要成分为
A.过量稀盐酸 B.适量Na2CO3溶液
C.适量磷酸溶液 D.过量CaCO3
(4)在沉锰过程中,应将Na2CO3溶液逐量加入锰盐溶液中,如果颠倒试剂混合顺序会有Mn(OH)2生成,其原因是Na2CO3溶液具有较强
(5)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为

(6)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
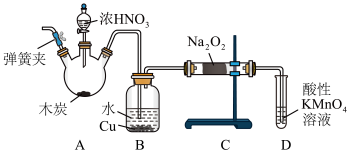
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体Ar,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。上述操作的作用是___ 。
(2)B中观察到的主要现象是___ ;
(3)A装置中反应的化学方程式为___ ;
(4)D装置中反应的离子方程式___ ;
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和___ 。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为___ 。
(6)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭___ g。

已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体Ar,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。上述操作的作用是
(2)B中观察到的主要现象是
(3)A装置中反应的化学方程式为
(4)D装置中反应的离子方程式
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和
(6)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______ (填字母)。
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____ (填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______ 。
(4)实验数据如下表,则该白醋的总酸度为_______ mol· L-1。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是
 |  |  |  |
| a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值
(3)实验iii中判断滴定终点的现象是
(4)实验数据如下表,则该白醋的总酸度为
| 待测液体积/mL | 标准NaOH溶液 | ||
| 滴定前读数/mL | 滴定终点读数/mL | ||
| 第1次 | 20.00 | 0 | 21.98 |
| 第2次 | 20.00 | 0 | 22.00 |
| 第3次 | 20.00 | 0 | 22.02 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】I.现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:

(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是:____________________ 。
(2)如果用酚酞做指示剂,试判断到达滴定终点的实验现象是____________________ 。
(3)如图1是酸式滴定管中液面在滴定前后的读数,c(NaOH)=____________ mol/L。
(4)若滴定前滴定管尖嘴部分留有有气泡,滴定后气泡消失,则测定的NaOH溶液的物质的量浓度________ (填“偏高”、“偏低”或“不影响”)。
II.如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
(1)曲线a是用__________ 溶液滴定____________ 溶液
(2)P点的坐标为( )
(3)盐酸的物质的量浓度为________ mol/L

(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是:
(2)如果用酚酞做指示剂,试判断到达滴定终点的实验现象是
(3)如图1是酸式滴定管中液面在滴定前后的读数,c(NaOH)=
(4)若滴定前滴定管尖嘴部分留有有气泡,滴定后气泡消失,则测定的NaOH溶液的物质的量浓度
II.如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
(1)曲线a是用
(2)P点的坐标为
(3)盐酸的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】常温下,某探究小组进行实验时,小组成员用浓度为 的稀盐酸滴定未知浓度的氨水,用甲基橙作指示剂。回答下列问题:
的稀盐酸滴定未知浓度的氨水,用甲基橙作指示剂。回答下列问题:
(1)用仪器甲量取 待测液,转移到仪器乙中,则仪器甲和仪器乙的名称分别是
待测液,转移到仪器乙中,则仪器甲和仪器乙的名称分别是___________ (填字母),其中需要用待测液润洗的仪器是___________ (填名称)。
a.量筒、酸式滴定管 b.碱式滴定管、烧杯
c.酸式滴定管、锥形瓶 d.碱式滴定管、锥形瓶
(2)达到滴定终点时,滴定管中稀盐酸的液面如图所示,其读数为______  ,若滴定前,滴定管中液体的读数是
,若滴定前,滴定管中液体的读数是 ,则该氨水的浓度为
,则该氨水的浓度为______  。
。

(3)下列操作能使测得的待测液浓度偏高的是___________ (填字母)。
a.酸式滴定管未用标准盐酸润洗
b.碱式滴定管用标准液润洗
c.移取待测液的过程中,开始时俯视滴定管液面读数,最后仰视液面读数
d.滴定前滴定管尖嘴中有气泡,滴定终点时气泡消失
e.滴定时标准液溅出
(4)滴定终点的现象是___________ 。
(5)滴定过程中所得溶液的pH变化曲线如图所示,B点时,溶液中离子浓度的大小顺序是___________ 。

 的稀盐酸滴定未知浓度的氨水,用甲基橙作指示剂。回答下列问题:
的稀盐酸滴定未知浓度的氨水,用甲基橙作指示剂。回答下列问题:(1)用仪器甲量取
 待测液,转移到仪器乙中,则仪器甲和仪器乙的名称分别是
待测液,转移到仪器乙中,则仪器甲和仪器乙的名称分别是a.量筒、酸式滴定管 b.碱式滴定管、烧杯
c.酸式滴定管、锥形瓶 d.碱式滴定管、锥形瓶
(2)达到滴定终点时,滴定管中稀盐酸的液面如图所示,其读数为
 ,若滴定前,滴定管中液体的读数是
,若滴定前,滴定管中液体的读数是 ,则该氨水的浓度为
,则该氨水的浓度为 。
。
(3)下列操作能使测得的待测液浓度偏高的是
a.酸式滴定管未用标准盐酸润洗
b.碱式滴定管用标准液润洗
c.移取待测液的过程中,开始时俯视滴定管液面读数,最后仰视液面读数
d.滴定前滴定管尖嘴中有气泡,滴定终点时气泡消失
e.滴定时标准液溅出
(4)滴定终点的现象是
(5)滴定过程中所得溶液的pH变化曲线如图所示,B点时,溶液中离子浓度的大小顺序是

您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】实验室用0.100mol•L﹣1NaOH标准溶液滴定未知浓度的盐酸。
(1)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的________ 操作。(填“甲”、“乙”、“丙”)

(2)选择酚酞作为指示剂,滴定终点的现象为____________________________________________ 。
(3)下列操作会导致实验结果偏低的是________________ 。(填标号)
A.碱式滴定管未用标准NaOH溶液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.滴定过程中振荡锥形瓶,液体不慎溅出
(4)某学生进行3次实验得到相关数据如表所示。
则盐酸的物质的量浓度为_____________________ mol•L﹣1.(保留三位小数)
(1)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的

(2)选择酚酞作为指示剂,滴定终点的现象为
(3)下列操作会导致实验结果偏低的是
A.碱式滴定管未用标准NaOH溶液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.滴定过程中振荡锥形瓶,液体不慎溅出
(4)某学生进行3次实验得到相关数据如表所示。
| 滴定次数 | 待测盐酸 的体积/mL | 消耗0.100mol•L﹣1NaOH溶液的体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】滴定实验是化学学科中重要的定量实验。 请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是___________ (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
①滴定时,KMnO4溶液应装在___________ (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是___________ 。
②该草酸溶液的物质的量浓度为___________ 。
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】某学生欲用已知物质的量浓度的盐酸来滴定未知浓度的氢氧化钠溶液,选择甲基橙作指示剂。请回答下列问题:
(1)用已知物质的量浓度的盐酸滴定时,应将盐酸注入滴定管___________ (选填“甲”或“乙”)中。

(2)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入 待测NaOH溶液,并加入2~3滴甲基橙
待测NaOH溶液,并加入2~3滴甲基橙
B.用标准溶液润洗酸式滴定管2~3次
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡
D.取标准盐酸注入酸式滴定管至刻度0以上
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度
最佳的操作步骤的顺序是___________ (用序号字母填写);判断到达滴定终点的实验现象是___________ 。
(3)下列操作中,可能使所测氢氧化钠溶液的浓度值偏低的是___________。
(4)若滴定开始和结束时,滴定管中的液面如图示,则所用盐酸溶液的体积为___________ mL。
(5)某学生根据三次实验分别记录有关数据如下表:
请用上述数据计算该NaOH溶液的物质的量浓度为:___________ mol/L。
(1)用已知物质的量浓度的盐酸滴定时,应将盐酸注入滴定管

(2)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入
 待测NaOH溶液,并加入2~3滴甲基橙
待测NaOH溶液,并加入2~3滴甲基橙B.用标准溶液润洗酸式滴定管2~3次
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡
D.取标准盐酸注入酸式滴定管至刻度0以上
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度
最佳的操作步骤的顺序是
(3)下列操作中,可能使所测氢氧化钠溶液的浓度值偏低的是___________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| C.读取盐酸体积时,滴定结束时俯视读数 |
| D.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |

(5)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.17 | 26.28 |
| 第二次 | 25.00 | 0.13 | 26.45 |
| 第三次 | 25.00 | 0.22 | 26.31 |
您最近一年使用:0次



