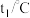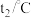回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 kJ,则原混合气体中CH4与H2的物质的量之比是___________ 。
(2)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则能表示CO燃烧热的热化学方程式为___________ 。
(3)嫦娥”五号预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:___________ 。
(4)已知:2Fe(s)+ O2(g)=Fe2O3(s) ΔH1 2Al(s)+
O2(g)=Fe2O3(s) ΔH1 2Al(s)+ O2(g)=Al2O3(s) ΔH2
O2(g)=Al2O3(s) ΔH2
计算2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH3=___________ (用上述有关ΔH表示);ΔH1_____ ΔH2(填<或=或>符号)
(5)下面列举了一些化学键的键能数据,供计算使用。
工业上的高纯硅可通过下列反应制取:SiCl4(g)+H2(g)→Si(s)+HCl(g),该反应的反应热化学方程式为为___________ 。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 kJ,则原混合气体中CH4与H2的物质的量之比是
(2)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则能表示CO燃烧热的热化学方程式为
(3)嫦娥”五号预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:
(4)已知:2Fe(s)+
 O2(g)=Fe2O3(s) ΔH1 2Al(s)+
O2(g)=Fe2O3(s) ΔH1 2Al(s)+ O2(g)=Al2O3(s) ΔH2
O2(g)=Al2O3(s) ΔH2计算2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH3=
(5)下面列举了一些化学键的键能数据,供计算使用。
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
更新时间:2021-12-03 17:10:39
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题
(1)乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产.已知:
甲醇脱水反应
甲醇制烯烃反应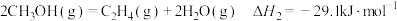
乙醇异构化反应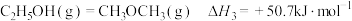
则乙烯气相直接水合反应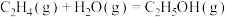 的
的
___________ 。
(2)已知白磷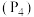 和
和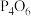 的分子结构和部分化学键的键能分别如图、表所示:
的分子结构和部分化学键的键能分别如图、表所示:

写出气态白磷与氧气反应生成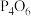 气体的热化学方程式:
气体的热化学方程式:________________________ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为______________ 。 分子中键角
分子中键角
_________  中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(4)超分子化学已逐渐扩展到化学的各个领域。由 将2个
将2个 分子、2个p-甲酸丁酯吡啶及2个
分子、2个p-甲酸丁酯吡啶及2个 分子利用配位键自组装的超分子结构如图所示。
分子利用配位键自组装的超分子结构如图所示。
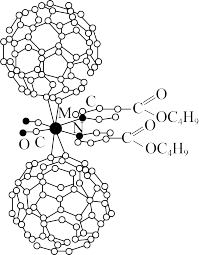
Mo处于第五周期第ⅥB族,价电子排布与Cr相似,基态Mo原子的价电子排布式是______ ,该超分子中存在的化学键类型有________ (填选项字母)。
A.离子键B.氢键C. 键D.
键D. 键
键
(5)有机化合物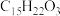 (
(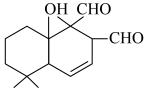 )是一种取代有机氯农药DDT的新型杀虫剂,该有机化合物分子中
)是一种取代有机氯农药DDT的新型杀虫剂,该有机化合物分子中 键和
键和 键个数之比为
键个数之比为_____________ 。
(6)已知有机物A的分子式为 ,它能在
,它能在 溶液中发生水解反应。A与B,C,D等物质存在如图所示的转化关系,写出实现下列变化的化学方程式。
溶液中发生水解反应。A与B,C,D等物质存在如图所示的转化关系,写出实现下列变化的化学方程式。
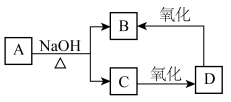
①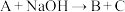 :
:_______________________________________________ 。
②C→D:_______________________________________________ 。
③D→B:_______________________________________________ 。
(1)乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产.已知:
甲醇脱水反应

甲醇制烯烃反应
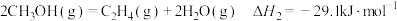
乙醇异构化反应
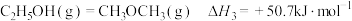
则乙烯气相直接水合反应
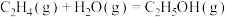 的
的
(2)已知白磷
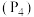 和
和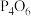 的分子结构和部分化学键的键能分别如图、表所示:
的分子结构和部分化学键的键能分别如图、表所示:
化学键 |
|
|
|
键能 |
|
|
|
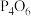 气体的热化学方程式:
气体的热化学方程式:(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(4)超分子化学已逐渐扩展到化学的各个领域。由
 将2个
将2个 分子、2个p-甲酸丁酯吡啶及2个
分子、2个p-甲酸丁酯吡啶及2个 分子利用配位键自组装的超分子结构如图所示。
分子利用配位键自组装的超分子结构如图所示。
Mo处于第五周期第ⅥB族,价电子排布与Cr相似,基态Mo原子的价电子排布式是
A.离子键B.氢键C.
 键D.
键D. 键
键(5)有机化合物
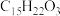 (
( )是一种取代有机氯农药DDT的新型杀虫剂,该有机化合物分子中
)是一种取代有机氯农药DDT的新型杀虫剂,该有机化合物分子中 键和
键和 键个数之比为
键个数之比为(6)已知有机物A的分子式为
 ,它能在
,它能在 溶液中发生水解反应。A与B,C,D等物质存在如图所示的转化关系,写出实现下列变化的化学方程式。
溶液中发生水解反应。A与B,C,D等物质存在如图所示的转化关系,写出实现下列变化的化学方程式。
①
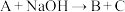 :
:②C→D:
③D→B:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知 和
和 的燃烧热
的燃烧热 分别为
分别为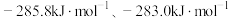 和-
和- 。请回答:
。请回答:
①用太阳能分解 水消耗的能量是
水消耗的能量是_______________ 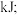
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______________ 。
(2)热力学标准态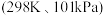 下,由稳定单质发生反应生成
下,由稳定单质发生反应生成 化合物的反应热叫该化合物的生成热
化合物的反应热叫该化合物的生成热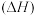 。如图为第VIA族元素(包括
。如图为第VIA族元素(包括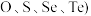 氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
氢化物a、b、c、d的生成热数据示意图。试完成下列问题。 对应的氢化物是
对应的氢化物是_______________ (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热 的关系是:
的关系是:_______________ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为_______________ 。
(沸点:硒化氢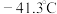 ;硒:
;硒: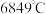 )
)
(3)某小组用 溶液和
溶液和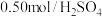 溶液进行中和热的测定。
溶液进行中和热的测定。
①取 溶液和
溶液和 溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。
近似认为 溶液和
溶液和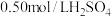 溶液的密度都是
溶液的密度都是 ,中和后混合溶液的比热容
,中和后混合溶液的比热容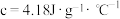 ,则
,则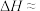
_________ (结果保留小数点后一位)。
②已知强酸强碱的稀溶液反应生成 液态
液态 时反应放出的热量为
时反应放出的热量为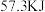 ,
,
上述实验产生偏差的原因可能是____________ (填字母)。
A.实验装置保温、隔热效果差
B.量取 溶液的体积时仰视读数
溶液的体积时仰视读数
C.把 溶液快速的一次性倒入盛有硫酸的量热计中
溶液快速的一次性倒入盛有硫酸的量热计中
D.用温度计测定 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度
(1)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知
 和
和 的燃烧热
的燃烧热 分别为
分别为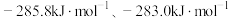 和-
和- 。请回答:
。请回答:①用太阳能分解
 水消耗的能量是
水消耗的能量是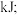
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(2)热力学标准态
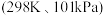 下,由稳定单质发生反应生成
下,由稳定单质发生反应生成 化合物的反应热叫该化合物的生成热
化合物的反应热叫该化合物的生成热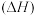 。如图为第VIA族元素(包括
。如图为第VIA族元素(包括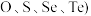 氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
氢化物a、b、c、d的生成热数据示意图。试完成下列问题。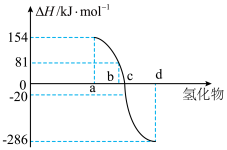
 对应的氢化物是
对应的氢化物是 的关系是:
的关系是:②硒化氢在上述条件下发生分解反应的热化学方程式为
(沸点:硒化氢
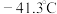 ;硒:
;硒: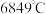 )
)(3)某小组用
 溶液和
溶液和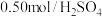 溶液进行中和热的测定。
溶液进行中和热的测定。①取
 溶液和
溶液和 溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。实验次数 | 起始温度 | 终止温度 | ||
|
| 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.9 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 26.3 | 26.1 | 26.2 | 30.2 |
 溶液和
溶液和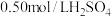 溶液的密度都是
溶液的密度都是 ,中和后混合溶液的比热容
,中和后混合溶液的比热容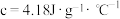 ,则
,则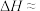
②已知强酸强碱的稀溶液反应生成
 液态
液态 时反应放出的热量为
时反应放出的热量为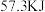 ,
,上述实验产生偏差的原因可能是
A.实验装置保温、隔热效果差
B.量取
 溶液的体积时仰视读数
溶液的体积时仰视读数C.把
 溶液快速的一次性倒入盛有硫酸的量热计中
溶液快速的一次性倒入盛有硫酸的量热计中D.用温度计测定
 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】依据事实,写出下列反应的热化学方程式。
⑴在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.7kJ。则表示甲醇燃烧热的热化学方程式为_________________________________ ;
工业上常用天然气作为制备CH3OH的原料。已知:
① CH4(g)+O2(g) CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol
CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol
② CH4(g)+ H2O(g) CO(g)+3H2(g) △H=+250. 3 kJ/mol
CO(g)+3H2(g) △H=+250. 3 kJ/mol
③ CO(g)+2H2(g) CH3OH(g) △H=-90.0 kJ/mol
CH3OH(g) △H=-90.0 kJ/mol
CH4(g)与O2(g)反应只生成CH3OH(g)的热化学方程式为_________________________ 。
⑵若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量。写出该反应的热化学方程式__________________________________ 。
⑶已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________ 。
⑷已知下列两个热化学方程式;
2H2(g)+ O2(g)﹦2H2O(1) △H=-571kJ/mol
C3H8(g)+5O2(g)﹦3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
实验测得H2和C3H8的混合气体共4mol,完全燃烧生成液态水时放热3076.5kJ,则混合气体中H2和C3H8的体积比为_______ 。
⑴在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.7kJ。则表示甲醇燃烧热的热化学方程式为
工业上常用天然气作为制备CH3OH的原料。已知:
① CH4(g)+O2(g)
 CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol
CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol② CH4(g)+ H2O(g)
 CO(g)+3H2(g) △H=+250. 3 kJ/mol
CO(g)+3H2(g) △H=+250. 3 kJ/mol③ CO(g)+2H2(g)
 CH3OH(g) △H=-90.0 kJ/mol
CH3OH(g) △H=-90.0 kJ/mol CH4(g)与O2(g)反应只生成CH3OH(g)的热化学方程式为
⑵若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量。写出该反应的热化学方程式
⑶已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
⑷已知下列两个热化学方程式;
2H2(g)+ O2(g)﹦2H2O(1) △H=-571kJ/mol
C3H8(g)+5O2(g)﹦3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
实验测得H2和C3H8的混合气体共4mol,完全燃烧生成液态水时放热3076.5kJ,则混合气体中H2和C3H8的体积比为
您最近一年使用:0次
【推荐1】回答下列问题
(1)甲醇是人们开发和利用的一种新能源。已知:
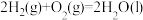
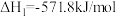
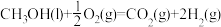
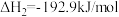
①表示甲醇燃烧热的热化学方程式为___________ ;
②上述第二个反应的能量变化如图所示,则 =
=___________ kJmol。(用E1、E2的相关式子表示);

(2)已知反应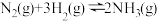
 ,试根据表中所列键能数据估算a=
,试根据表中所列键能数据估算a=___________ 。
(3) 和
和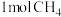 完全燃烧放出的热量分别为:286kJ、890kJ,等质量的H2和CH4完全燃烧放出的热量,
完全燃烧放出的热量分别为:286kJ、890kJ,等质量的H2和CH4完全燃烧放出的热量,___________ (填化学式)放出的热量多。
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:___________ 。
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___________ 。
(1)甲醇是人们开发和利用的一种新能源。已知:
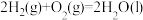
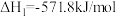
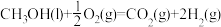
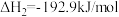
①表示甲醇燃烧热的热化学方程式为
②上述第二个反应的能量变化如图所示,则
 =
=
(2)已知反应
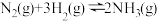
 ,试根据表中所列键能数据估算a=
,试根据表中所列键能数据估算a=| 化学键 | H-H | N-H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
 和
和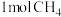 完全燃烧放出的热量分别为:286kJ、890kJ,等质量的H2和CH4完全燃烧放出的热量,
完全燃烧放出的热量分别为:286kJ、890kJ,等质量的H2和CH4完全燃烧放出的热量,(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】依据事实,写出下列反应的热化学方程式。
(1)0.25molC2H5OH完全燃烧生成液态水时放出341.7kJ热量,则表示C2H5OH燃烧热的热化学方程_______ 。
(2)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量_______ 。
(3)已知0.5 molCH4与0.5mol水蒸气在t℃、pkPa时,完全反应生成CO和H2,吸收了akJ热量_______ 。
(4)2 mol Al(s)与适量O2(g)发生反应,生成Al2O3(s),放出1 669.8 kJ的热量_______ 。
(5)已知CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。写出CH3OH(l)不完全燃烧生成CO和液态水的热化学方程式_______ 。
(1)0.25molC2H5OH完全燃烧生成液态水时放出341.7kJ热量,则表示C2H5OH燃烧热的热化学方程
(2)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量
(3)已知0.5 molCH4与0.5mol水蒸气在t℃、pkPa时,完全反应生成CO和H2,吸收了akJ热量
(4)2 mol Al(s)与适量O2(g)发生反应,生成Al2O3(s),放出1 669.8 kJ的热量
(5)已知CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。写出CH3OH(l)不完全燃烧生成CO和液态水的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)已知某反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。

该反应是____ (填“吸热”或“放热”)反应,该反应的ΔH=_____ kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式___________________________ 。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为______ kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________ 。
 C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
该反应是
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题。回答下列问题:
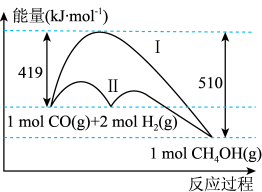
(1)工业上用CO生产燃料甲醇,一定条件下发生反应: ,反应过程中的能量变化情况如图所示。曲线
,反应过程中的能量变化情况如图所示。曲线_______ (选填“Ⅰ”或“Ⅱ”)表示使用催化剂的反应过程。计算当反应生成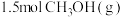 时,能量变化值是
时,能量变化值是_______ kJ。
(2)用 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有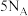 个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为_______ 。
(3)已知拆开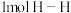 键、
键、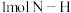 键、
键、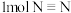 键分别需要的能量是436kJ、391kJ、946kJ,则
键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成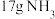 需放出的热量为
需放出的热量为_______ kJ。
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
已知:①

②

③

④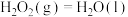

则表示 燃烧生成
燃烧生成 气体和液态水的反应热
气体和液态水的反应热 为
为_______  (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(5)已知乙醇的燃烧热为 。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是
。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是_______  。(取小数点后一位)
。(取小数点后一位)
(1)工业上用CO生产燃料甲醇,一定条件下发生反应:
 ,反应过程中的能量变化情况如图所示。曲线
,反应过程中的能量变化情况如图所示。曲线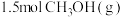 时,能量变化值是
时,能量变化值是
(2)用
 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有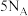 个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为(3)已知拆开
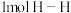 键、
键、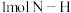 键、
键、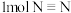 键分别需要的能量是436kJ、391kJ、946kJ,则
键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成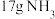 需放出的热量为
需放出的热量为(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用
 生产甲醇燃料的方法:
生产甲醇燃料的方法:已知:①


②


③


④
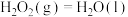

则表示
 燃烧生成
燃烧生成 气体和液态水的反应热
气体和液态水的反应热 为
为 (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。(5)已知乙醇的燃烧热为
 。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是
。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是 。(取小数点后一位)
。(取小数点后一位)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)氢气是一种热值高、环境友好型燃料。等物质的量的氢气完全燃烧生成液态水与生成气态水相比,生成液态水时放出热量_______ (填“多”“少”或“相等”)。
(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H─N键能为391 kJ/mol,N≡N键能为946 kJ/mol。根据键能计算工业合成氨时消耗1molN2能_______ (填“吸收”或“放出”)_______ kJ热量。

(3)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,Cu电极上的可以看到的现象_______ ,SO 向
向_______ 极(填a或b)移动,正极的电极反应式为_______ 。
(4)若电极a为Fe、电极b为Ag、电解质溶液为硝酸银,该原电池工作时,原电池的负极材料为_______ ,电子沿导线向_______ (填a/b)移动。
(5)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,并在下面方框内画出原电池实验装置图,注明电极材料和电解质溶液等_______ 。当线路中转移0.4mol电子时,则被腐蚀铜的质量为_______ g。

(1)氢气是一种热值高、环境友好型燃料。等物质的量的氢气完全燃烧生成液态水与生成气态水相比,生成液态水时放出热量
(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H─N键能为391 kJ/mol,N≡N键能为946 kJ/mol。根据键能计算工业合成氨时消耗1molN2能

(3)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,Cu电极上的可以看到的现象
 向
向(4)若电极a为Fe、电极b为Ag、电解质溶液为硝酸银,该原电池工作时,原电池的负极材料为
(5)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,并在下面方框内画出原电池实验装置图,注明电极材料和电解质溶液等

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】按要求填空:
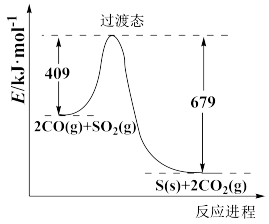
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下由SO2和CO反应生成S和CO2的能量变化如图所示,若反应中有48g S(s)生成,则该反应___________ (填“放出”或“吸收”)的热量为___________ 。
(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气中安装催化转化器,可有效降低NOx和CO的排放。已知:
a.2CO(g)+O2(g) 2CO2(g) ∆H=-566.0kJ·mol-1
2CO2(g) ∆H=-566.0kJ·mol-1
b.N2(g)+O2(g) 2NO(g) ∆H=+180.5kJ·mol-1
2NO(g) ∆H=+180.5kJ·mol-1
回答下列问题
①CO的燃烧热为___________ 。
②CO将NO还原为N2的热化学方程式为___________ 。
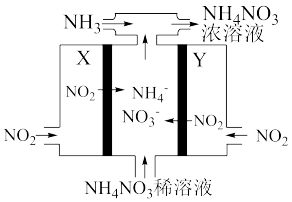
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。电解NO2制备NH4NO3原理如图所示。阳极为___________ (填“X”或“Y”),Y的电极反应式为___________ 。
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下由SO2和CO反应生成S和CO2的能量变化如图所示,若反应中有48g S(s)生成,则该反应

(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气中安装催化转化器,可有效降低NOx和CO的排放。已知:
a.2CO(g)+O2(g)
 2CO2(g) ∆H=-566.0kJ·mol-1
2CO2(g) ∆H=-566.0kJ·mol-1b.N2(g)+O2(g)
 2NO(g) ∆H=+180.5kJ·mol-1
2NO(g) ∆H=+180.5kJ·mol-1回答下列问题
①CO的燃烧热为
②CO将NO还原为N2的热化学方程式为
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。电解NO2制备NH4NO3原理如图所示。阳极为

您最近一年使用:0次