我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如所示。
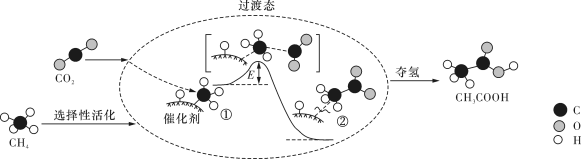
下列说法正确的是

下列说法正确的是
| A.该催化剂可有效提高反应物的平衡转化率 |
| B.CH4→CH3COOH过程中,有C—C键发生断裂 |
| C.生成CH3COOH总反应的原子利用率为100% |
| D.①→②的反应过程中,吸收能量并形成了O—H键 |
更新时间:2022-03-23 15:34:51
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】科学家提出一种大气中 在
在 和
和 作用下转变为
作用下转变为 的机理(图1),其能量变化如图2所示。
的机理(图1),其能量变化如图2所示。不正确 的是
 在
在 和
和 作用下转变为
作用下转变为 的机理(图1),其能量变化如图2所示。
的机理(图1),其能量变化如图2所示。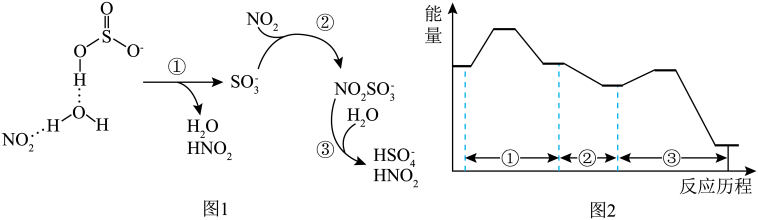
已知: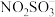 的结构式为
的结构式为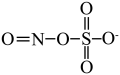
A.①中涉及 键的断裂与生成 键的断裂与生成 | B.②③均发生了氧化还原反应 |
| C.由图2可知,该过程的决速步是① | D.总反应中还原剂与氧化剂的物质的量之比为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法不正确的是
| A.在其他外界条件不变的情况下,增大压强,不能增大活化分子的百分数 |
B.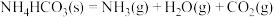 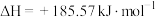 能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
D. 、 、 的反应在任何温度下都能自发进行 的反应在任何温度下都能自发进行 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列图示与对应的叙述相符的是( )


A.由图甲可知,2SO3(g) 2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1 2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1 |
| B.图乙表示0.1 mol MgCl2·6H2O在空气中充分加热时残留固体质量随时间的变化 |
| C.图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中存在大量Al3+ |
| D.图丁表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1的H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对反应有催化作用) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】资料显示:自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
下列说法不正确 的是
| 实验① | 实验② | 实验③ |
 |  |  |
| 褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法
| A.实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用 |
| B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率 |
| C.实验③褪色比①快,是因为Cl—的催化作用加快了反应速率 |
| D.若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快 |
您最近一年使用:0次